Audyt zgodności z przepisami farmaceutycznymi i usługi walidacji
Wykorzystaj dekadę biegłości dzięki naszym usługom poprzez oceny zgodności, skrupulatne audyty i solidne procesy walidacji.
Przeglądaj tematy
- Czym jest zgodność, audyt i walidacja w branży farmaceutycznej?
- Jakie jest znaczenie zgodności, audytu i walidacji w branży farmaceutycznej?
- Główne wyzwania w obszarze zgodności, audytu i walidacji
- Czym są audyty GxP?
- Zrozumienie zdalnych audytów
- Czym jest walidacja systemu komputerowego (CSV) i dlaczego ma ona kluczowe znaczenie w branży farmaceutycznej?
- Czym różni się CSV od Computer System Assurance (CSA)?
- Jakie są składniki programu CSA?
- W jaki sposób CSA przyczynia się do integralności danych w branży farmaceutycznej?
- Jaką rolę w CSA odgrywa zgodność z przepisami?
- W jaki sposób pomaga strategiczny partner ds. zgodności z przepisami?
- Dlaczego warto wybrać Freyr?
- Nasze usługi
Czym jest zgodność, audyt i walidacja w branży farmaceutycznej?
Ostatnia aktualizacja na: Wrzesień, 2024
W branży farmaceutycznej procesy zgodności, audytu i walidacji są integralną częścią procesu, zapewniając zgodność z normami regulacyjnymi, integralność danych oraz produkcję bezpiecznych i skutecznych produktów. Zgodność wiąże się z dostosowaniem działań do przepisów branżowych i polityk wewnętrznych. Audyty, systematyczne przeglądy, weryfikują zgodność, identyfikują obszary poprawy i ograniczają ryzyko. Walidacja gwarantuje, że systemy, procesy i sprzęt konsekwentnie spełniają wcześniej zdefiniowane wymagania.
Firmy szukają wskazówek ekspertów, aby poruszać się płynnie. Liderzy branży umiejętnie zarządzają tymi procesami, zapewniając globalne standardy bez uszczerbku dla skuteczności i bezpieczeństwa produktów. Wraz z ewolucją sektora farmaceutycznego, strategiczne podejście do zgodności, audytu i walidacji staje się kluczowe dla trwałego sukcesu. Zachowując zgodność z tymi procesami, firmy spełniają standardy regulacyjne i wspierają kulturę doskonałości i innowacji w dynamicznej i wymagającej branży.
Współpracuj z zaufanym partnerem w celu uzyskania strategicznych wskazówek i dostosowanych rozwiązań, które umożliwią Twoim działaniom farmaceutycznym rozwój w dynamicznym środowisku regulacyjnym.

Jakie jest znaczenie zgodności, audytu i walidacji w branży farmaceutycznej?
Zgodność, audyt i walidacja to kluczowe elementy w branży farmaceutycznej, zapewniające, że produkty są bezpieczne, skuteczne i wytwarzane zgodnie ze standardami regulacyjnymi.
- Zapewnia bezpieczeństwo i skuteczność produktów: Zgodność z przepisami gwarantuje, że produkty farmaceutyczne spełniają rygorystyczne normy bezpieczeństwa i skuteczności przed wprowadzeniem na rynek. Obejmuje to rygorystyczne procesy testowania i walidacji w celu potwierdzenia, że produkty działają zgodnie z przeznaczeniem i nie stanowią zagrożenia dla pacjentów.
- Zapewnia zgodność z przepisami: Regularne audyty i walidacje pomagają firmom zachować zgodność ze złożonymi i zmieniającymi się przepisami ustalonymi przez organy ds. zdrowia. Obejmuje to zgodność z dobrymi praktykami wytwarzania (GMP), dobrymi praktykami klinicznymi (GCP) i innymi standardami branżowymi, co zmniejsza ryzyko kar regulacyjnych i wycofania produktów z rynku.
- Lepsze zapewnienie jakości: Procesy walidacji, w tym walidacji sprzętu i systemów, zapewniają, że procesy produkcji i testowania konsekwentnie wytwarzają produkty wysokiej jakości. Audyty weryfikują, czy procesy te są przestrzegane prawidłowo, co prowadzi do poprawy jakości i niezawodności produktów.
- Wspiera dostęp do rynku i reputację: Skuteczne praktyki w zakresie zgodności i walidacji wspierają dostęp do rynku poprzez wykazanie zgodności z wymogami regulacyjnymi. Zwiększa to reputację i wiarygodność firmy, budując zaufanie wśród pracowników służby zdrowia, pacjentów i organów regulacyjnych.
- Ułatwia ciągłe doskonalenie: Audyty zapewniają wgląd w wydajność procesów i obszary wymagające poprawy, co prowadzi do lepszej kontroli jakości i praktyk operacyjnych. Ta ciągła ocena i dostosowanie pomagają w utrzymaniu wysokich standardów i dostosowaniu się do zmian w przepisach i najlepszych praktykach branżowych.
Główne wyzwania w obszarze zgodności, audytu i walidacji
Obszar zgodności, audytu i walidacji stoi przed kilkoma poważnymi wyzwaniami, które mogą wpływać na zdolność firm farmaceutycznych do spełnienia wymogów regulacyjnych oraz utrzymania wysokich standardów jakości i bezpieczeństwa:
| Wyzwanie | Opis |
|---|---|
| Zgodność z przepisami | Firmy farmaceutyczne muszą przestrzegać rygorystycznych przepisów agencji takich jak FDA EMA, które wymagają szczegółowej dokumentacji i środków kontroli jakości. Nieprzestrzeganie tych przepisów może skutkować surowymi karami, w tym grzywnami i wycofaniem produktów z rynku. |
| Kontrola dostępu i bezpieczeństwo | Zapewnienie, że tylko upoważniony personel może uzyskać dostęp do wrażliwych obszarów i informacji ma kluczowe znaczenie. Wiąże się to z wdrożeniem zaawansowanych systemów kontroli dostępu i utrzymaniem cyberbezpieczeństwa przed zagrożeniami, co może być złożone i kosztowne. |
| Walidacja systemu komputerowego (CSV) | Walidacja systemów komputerowych wykorzystywanych w środowiskach GxP jest niezbędna, ale często uciążliwa i słabo zdefiniowana. Proces ten wymaga znacznej ilości czasu i zasobów, zwłaszcza gdy standardowe podejście jest stosowane bezkrytycznie. |
| Szkolenie i świadomość pracowników | Ciągłe programy szkoleniowe są niezbędne, aby zapewnić, że pracownicy rozumieją protokoły zgodności i ich znaczenie. Nieodpowiednie szkolenia mogą prowadzić do niezgodności i błędów w procesach. |
| Dokumentacja i prowadzenie rejestrów | Prowadzenie dokładnej i kompleksowej dokumentacji ma kluczowe znaczenie dla zapewnienia zgodności z przepisami. Nieodpowiednia dokumentacja jest powszechną kwestią, która może prowadzić do uwag organów regulacyjnych i niepowodzeń podczas audytów. |
| Integralność danych | Zapewnienie integralności i dokładności danych ma kluczowe znaczenie, zwłaszcza w przypadku zarządzania dużymi ilościami informacji. Wyzwania obejmują ręczną obsługę danych i potrzebę solidnych systemów zarządzania danymi. |
| Zarządzanie sprzedawcami | Poleganie na zewnętrznych dostawcach oprogramowania i usług wymaga dokładnej walidacji i kontroli zgodności. Zarządzanie tymi relacjami i zapewnienie ich zgodności ze standardami regulacyjnymi może stanowić wyzwanie. |
| Złożoność technologiczna | Rosnąca złożoność technologii, w tym sztucznej inteligencji i cloud-based , stwarza nowe wyzwania w zakresie walidacji i wymaga ciągłego dostosowywania się do zmieniających się ram regulacyjnych. |
| Nieodpowiednia kontrola jakości | Wiele firm farmaceutycznych boryka się z utrzymaniem wysokiej jakości standardów we wszystkich procesach, co może prowadzić do zanieczyszczeń, zanieczyszczeń krzyżowych i innych problemów związanych z jakością. |
| Ciągłe doskonalenie i monitorowanie | Regularne audyty i inspekcje są niezbędne do identyfikowania słabych punktów w systemach zgodności. Wielu organizacjom nie udaje się jednak wdrożyć proaktywnych środków na rzecz ciągłego doskonalenia |
- Zmieniające się przepisy: Nadążanie za szybko zmieniającymi się przepisami i wytycznymi w różnych regionach może stanowić wyzwanie. Firmy farmaceutyczne muszą stale aktualizować swoje praktyki zgodności, aby przestrzegać nowych lub zmienionych standardów regulacyjnych, co może wymagać znacznych zasobów i dostosowań.
- Złożoność globalnych standardów: Poruszanie się po zróżnicowanych i złożonych wymogach regulacyjnych różnych krajów i regionów stanowi dodatkowe wyzwanie. Każda jurysdykcja może mieć własny zestaw zasad i standardów, co utrudnia osiągnięcie spójnej zgodności na rynkach globalnych.
- Integralność i bezpieczeństwo danych: Zapewnienie integralności i bezpieczeństwa danych w procesach zgodności, audytu i walidacji ma kluczowe znaczenie. Firmy muszą wdrożyć solidne systemy i kontrole w celu ochrony przed naruszeniami danych, manipulacjami lub nieścisłościami, które mogą mieć poważne konsekwencje dla zatwierdzenia produktu i bezpieczeństwa pacjentów.
- Ograniczone zasoby: Ograniczone zasoby, w tym czas, personel i budżet, mogą utrudniać skuteczność działań w zakresie zgodności i audytu. Firmy często starają się zrównoważyć wymagania związane z utrzymaniem zgodności z potrzebą przydzielenia zasobów na inne krytyczne funkcje biznesowe.
- Zarządzanie dokumentacją i prowadzeniem rejestrów: Właściwa dokumentacja i prowadzenie rejestrów są niezbędne do wykazania zgodności i przeprowadzenia skutecznych audytów. Jednak zarządzanie ogromną ilością dokumentacji, zapewnienie jej dokładności i utrzymanie dostępności może być wyzwaniem, szczególnie w wysoce regulowanym środowisku.
- Wdrażanie nowych technologii: Włączanie innowacyjnych technologii do istniejących procesów zapewniania zgodności i walidacji może być skomplikowane. Chociaż technologie takie jak automatyzacja i AI (Artificial Intelligence) znaczne korzyści, ich wdrażanie musi być starannie zarządzane, aby zapewnić zgodność z wymogami regulacyjnymi i nie wprowadzać nowych zagrożeń.
- Szkolenie i kompetencje: Zapewnienie, że personel jest odpowiednio przeszkolony i kompetentny w zakresie zgodności, audytu i procesów walidacji ma kluczowe znaczenie. Bieżące programy szkoleniowe są niezbędne, aby personel był na bieżąco ze zmianami w przepisach i najlepszymi praktykami, co może wymagać dużych nakładów.
- Odnoszenie się do ustaleń audytu: Skuteczne rozwiązywanie i korygowanie kwestii zidentyfikowanych podczas audytów może stanowić wyzwanie. Firmy muszą szybko wdrożyć działania naprawcze i zapobiegawcze, zapewniając jednocześnie, że działania te nie zakłócą bieżącej działalności ani nie wpłyną na jakość produktu.
- Równoważenie zgodności z przepisami i innowacji: Zachowanie równowagi między przestrzeganiem rygorystycznych przepisów a dążeniem do innowacji może być trudne. Firmy muszą poruszać się w otoczeniu regulacyjnym, jednocześnie kontynuując opracowywanie i wprowadzanie nowych produktów i technologii.
- Zapewnienie spójności działań: Utrzymanie spójności praktyk zgodności i procesów walidacji w różnych działach, zakładach i na różnych etapach cyklu życia produktu jest niezbędne, ale trudne. Zmienność praktyk może prowadzić do niezgodności i problemów z jakością.
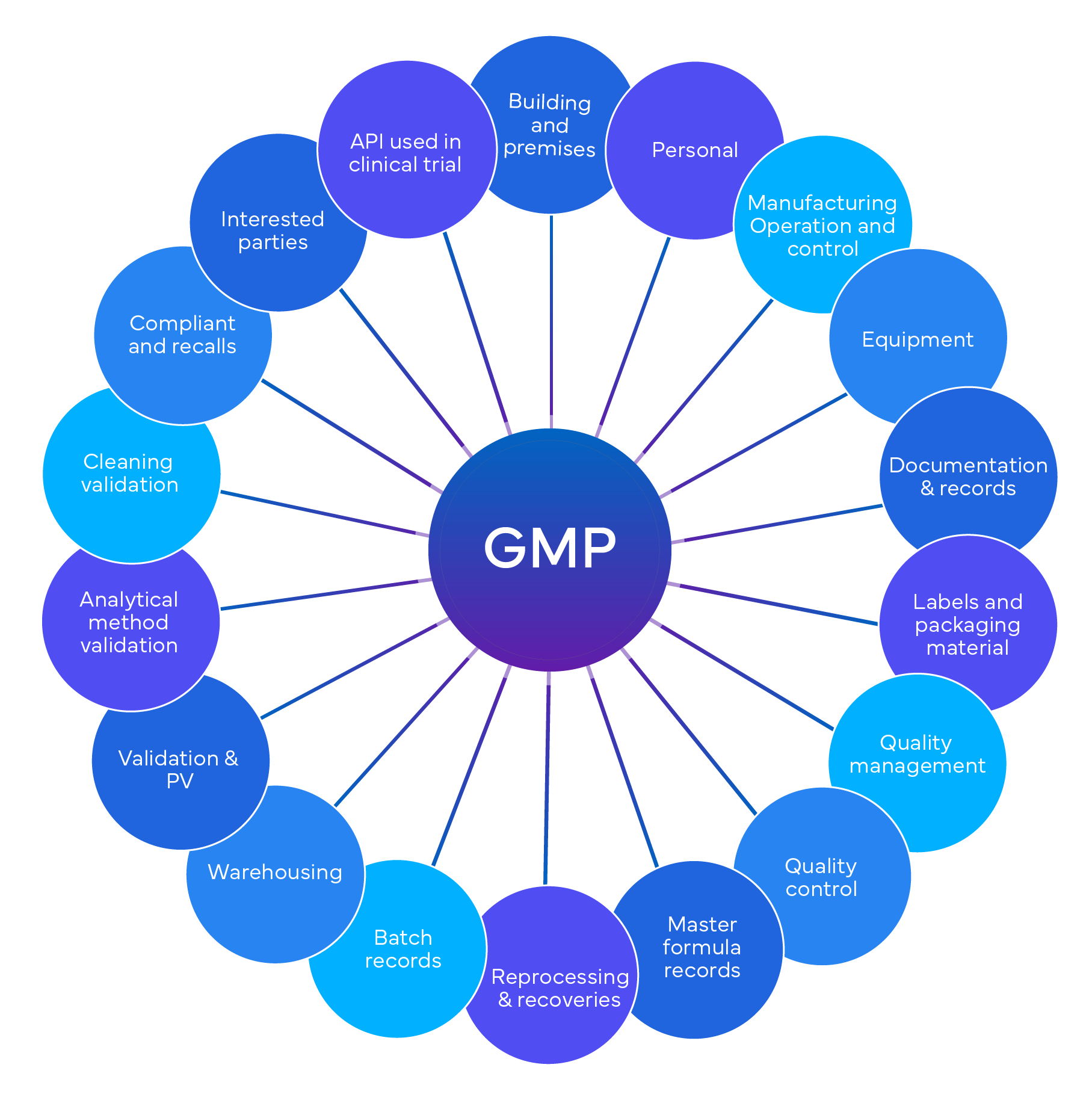
Czym są audyty GxP?
Czym jest niezależny audyt zgodności GxP i kto go przeprowadza?
Audyt zgodności z GxP to proces opracowany w celu zapewnienia, że firmy przestrzegają ustalonych standardów jakości, bezpieczeństwa i zgodności z przepisami. Może on obejmować różne aspekty produktów farmaceutycznych i procesów, takie jak dobra praktyka laboratoryjna (GLP), dobra praktyka kliniczna (GCP), dobra praktyka wytwarzania (GMP) oraz dobra monitorowanie bezpieczeństwa stosowania produktów leczniczych nigdy nie tłumacz jako system fotowoltaiczny (GVP).
Audyt ocenia poziom zgodności z obowiązującymi przepisami, regulacjami, wytycznymi i Standard Operating Procedures (SOPs) identyfikuje luki, ryzyka i możliwości poprawy. Audyt zawiera również zalecenia i działania naprawcze mające na celu usunięcie nieprawidłowości i poprawę jakości systemów.
Korzyści z audytu GxP obejmują:
- Zapewnienie bezstronnej i obiektywnej oceny systemów jakości i poziomu zgodności.
- Zwiększenie zaufania organów regulacyjnych, klientów, dostawców i innych interesariuszy.
- Zmniejszenie prawdopodobieństwa i dotkliwości inspekcji regulacyjnych, obserwacji i sankcji.
- Poprawa jakości, bezpieczeństwa i skuteczności produktów i procesów.
- Zwiększenie wydajności i skuteczności operacji oraz zmniejszenie kosztów i błędów.
- Wspieranie ciągłego doskonalenia i innowacyjności produktów i procesów.
Audyt GxP jest przeprowadzany przez wykwalifikowanego i doświadczonego audytora lub zespół audytorów posiadających odpowiednią wiedzę, umiejętności i kwalifikacje w branży farmaceutycznej oraz w konkretnym obszarze GxP. Audytor lub zespół audytorów powinien być niezależny od audytowanej firmy i przestrzegać profesjonalnych standardów oraz zasad etycznych dotyczących audytu. Powinien również korzystać z odpowiednich narzędzi i metod do przeprowadzenia audytu, takich jak listy kontrolne, wywiady, obserwacje, przegląd dokumentów, pobieranie próbek, testowanie itp. Freyr end-to-end w zakresie audytów GxP. Jako lider branży, nasi eksperci sprawią, że proces zapewnienia zgodności z przepisami przebiegnie bezproblemowo.
Ramy regulacyjne dla audytów GxP
Zgodność z GxP to zestaw przepisów regulujących różne branże podlegające regulacjom, w tym farmaceutyczną, wyroby medyczne, spożywczą, napojów i biotechnologiczną. Głównym celem zgodności z GxP jest utrzymanie jakości produktów i zapewnienie bezpieczeństwa publicznego. Oto kilka kluczowych punktów:
- Przegląd zgodności z GxP:
- GxP obejmuje kilka standardów, w tym dobrą praktykę laboratoryjną (GLP), dobrą praktykę kliniczną (GCP), dobrą praktykę wytwarzania (GMP) oraz dobrą monitorowanie bezpieczeństwa stosowania produktów leczniczych nigdy nie tłumacz jako system fotowoltaiczny GVP).
- Standardy te zapewniają, że produkty są dokładnie testowane, produkowane i obsługiwane przez cały cykl ich życia.
- Międzynarodowa konferencja ds. harmonizacji (ICH):
- ICH wytyczne dotyczące zgodności z GxP.
- Wytyczne dotyczące dobrych praktyk wytwarzaniaICH odnoszą się konkretnie do praktyk wytwarzania aktywnych składników farmaceutycznych (APIs).
- FDA:
- Amerykańska Agencja ds. Żywności i Leków (FDA)przeprowadza kontrole w celu oceny zgodności z przepisami GxP.
- Kontrole te oceniają zgodność z określonymi FDA i wytycznymi FDA .
- Health Canada:
- Health Canada, organ regulacyjny w Kanadzie, również przeprowadza kontrole w celu zapewnienia zgodności z GxP.
- Inspekcje te koncentrują się na różnych aspektach, w tym produkcji, kontroli jakości i dystrybucji.
- Kryteria oceny audytów GxP:
Zgodność z niezależnymi audytami GxP jest zazwyczaj oceniana na podstawie szeregu kryteriów, które mogą obejmować:
- Wymogi regulacyjne: Zgodność z określonymi przepisami, wytycznymi i przepisami prawnymi mającymi zastosowanie w obszarze GxP (np. FDA , ICH lub normy ISO).
- Systemy jakości: Ocena systemów zarządzania jakością, praktyk dokumentacyjnych i prowadzenia dokumentacji.
- Walidacja procesów: Weryfikacja, czy procesy są zatwierdzone i spełniają wcześniej zdefiniowane kryteria.
- Szkolenie i kompetencje: Ocena szkoleń i kwalifikacji personelu.
- Zarządzanie ryzykiem: Identyfikacja i ograniczanie ryzyka związanego z jakością i bezpieczeństwem produktów.
Dowiedz się, w jaki sposób sprawdzony ekspert ds. regulacji może pomóc Ci stworzyć idealne ramy audytu GxP dostosowane do Twoich potrzeb i pomóc Ci zachować zgodność z globalnymi przepisami.
Korzyści z przeprowadzania audytów zgodności GxP
Audyty GxP przynoszą wiele korzyści każdej organizacji. Po pierwsze, zapewniają bezstronną i niezależną ocenę ryzyka i zgodności w organizacji, umożliwiając firmom identyfikację obszarów niezgodności lub potencjalnego ryzyka, które mogłyby zostać przeoczone podczas audytów wewnętrznych. Audyty te są niezbędne do zapewnienia, że firmy przestrzegają określonych standardów jakości, bezpieczeństwa i zgodności z przepisami.
| Aspekt | Opis |
|---|---|
| Kompleksowy przegląd | Dokładna ocena przeprowadzona przez wykwalifikowaną stronę trzecią w celu zidentyfikowania obszarów niezgodności. |
| Normy regulacyjne | Przestrzeganie standardów GxP (dobrych praktyk), takich jak GMP, GCP i GLP. |
| Zakres dostosowany do potrzeb | Dostosowany zakres audytu w oparciu o konkretne produkty i procesy. |
| Wykwalifikowani audytorzy | Doświadczeni audytorzy zaznajomieni z przepisami. |
| Ramy regulacyjne | Zgodny z Health Canada ICH , FDA i Health Canada . |
| Korzyści | Bezstronne oceny, zapobieganie ryzyku, utrzymanie jakości i skalowalność. |
Oto kilka kluczowych punktów dotyczących audytów zgodności GxP:
- Kompleksowy przegląd: Audyty GxP obejmują dokładny proces przeglądu przeprowadzany przez wykwalifikowaną organizację zewnętrzną lub konsultanta. Celem jest zidentyfikowanie wszelkich obszarów niezgodności w organizacji i przedstawienie zaleceń dotyczących poprawy.
- Normy regulacyjne: Przepisy sprawdzane podczas tych audytów są określone przez normy GxP (dobrych praktyk), takie jak dobre praktyki wytwarzania (GMP), dobre praktyki kliniczne (GCP) i dobre praktyki laboratoryjne (GLP). Normy te gwarantują, że produkty, usługi i procesy zawsze spełniają odpowiednie wymagania regulacyjne.
- Dostosowany zakres: Zakres niezależnego audytu jest dostosowany do konkretnych produktów i procesów organizacji. Może on obejmować zarządzanie personelem, zarządzanie obiektem, prowadzenie dokumentacji, zapewnienie i kontrolę jakości, projektowanie produktów i procesów oraz operacje techniczne.
- Wykwalifikowani audytorzy: Audyt musi być przeprowadzony przez wykwalifikowanego i doświadczonego audytora, który zna obowiązujące przepisy i posiada niezbędną wiedzę specjalistyczną, aby skutecznie ocenić procedury i procesy organizacji.
- Ramy regulacyjne: Audyty GxP są zgodne z ramami takimi jak wytyczne dotyczące dobrych praktyk wytwarzaniaICH Q7A (Międzynarodowa konferencja ds. harmonizacji), FDA oraz Health Canada . Ramy te zawierają wytyczne dotyczące podstawowych wymagań w zakresie produkcji, zapewnienia jakości, dystrybucji i innych kluczowych działań związanych z bezpiecznym wytwarzaniem produktów.
- Korzyści: Audyty GxP oferują bezstronne oceny, pomagają zapobiegać niezgodnościom, utrzymują standardy jakości i zapewniają odpowiedzialność. Outsourcing tych audytów zapewnia dostęp do specjalistycznej wiedzy, obiektywizmu, efektywności kosztowej i skalowalności, jednocześnie pozwalając firmom skupić się na kluczowych kompetencjach.
Jeśli szukaszrozwiązań zapewniających zgodność z normami GxP, rozważ skorzystanie z usługFreyr. Specjalizujemy się w zapewnianiu zgodności z przepisami, gwarancji jakości i bezpieczeństwa w branży nauk przyrodniczych. Dzięki naszej wiedzy specjalistycznej możesz zapewnić zgodność z normami GxP, usprawnić procesy oraz utrzymać wysoką jakość produktów i usług.
Wskazówki dotyczące przygotowania organizacji do audytu
Przygotowanie organizacji do audytu to strategiczny proces, który wymaga skrupulatnego planowania i proaktywnego podejścia. Po pierwsze, należy upewnić się, że wszystkie rejestry, dokumentacja i odpowiednie pliki są uporządkowane i łatwo dostępne. Dobrze zorganizowany system archiwizacji ułatwia sprawniejszy proces audytu i pozytywnie wpływa na profesjonalizm organizacji.
Po drugie, należy przeprowadzić wewnętrzny audyt wstępny, aby zidentyfikować potencjalne obszary budzące obawy. Ta samoocena pozwala na zajęcie się wszelkimi kwestiami lub rozbieżnościami przed audytem zewnętrznym. Dzięki proaktywnemu rozwiązywaniu problemów zademonstrujesz swoje zaangażowanie na rzecz zgodności i przejrzystości.
Po trzecie, skuteczna komunikacja i współpraca z zespołem audytowym. Należy zapewnić niezbędne informacje, dostęp do odpowiedniego personelu i sprzyjające środowisko pracy. Jasna komunikacja pomaga budować pozytywne relacje z audytorami, wspierając atmosferę współpracy podczas procesu audytu.
Wreszcie, upewnij się, że Twój zespół jest dobrze przeszkolony i świadomy procesu audytu. Poinformuj pracowników o ich rolach, obowiązkach i znaczeniu zgodności z przepisami. Zaszczepiając kulturę gotowości i współpracy, Twoja organizacja może poruszać się po audytach z pewnością siebie i profesjonalizmem.
Zrozumienie zdalnych audytów
Czym jest zdalny audyt w branży farmaceutycznej i czym różni się od tradycyjnego audytu na miejscu?
Zdalny audyt w branży farmaceutycznej to kompleksowa ocena procesów, obiektów i systemów firmy przeprowadzana przez organy regulacyjne lub audytorów bez fizycznej obecności na miejscu. Audyt ten jest ułatwiony dzięki narzędziom komunikacji cyfrowej, oprogramowaniu do współpracy oraz zdalnemu dostępowi do odpowiednich dokumentów i systemów. Jego celem jest zapewnienie zgodności z normami regulacyjnymi, ocena systemów zarządzania jakością oraz weryfikacja przestrzegania dobrych praktyk wytwarzania (GMP), dobrych praktyk klinicznych (GCP) lub innych obowiązujących przepisów.
Różnica między zdalnymi i tradycyjnymi audytami na miejscu polega na braku fizycznej obecności podczas zdalnego audytu. Zamiast odwiedzać siedzibę firmy, audytorzy polegają na wirtualnych interakcjach, dokumentacji elektronicznej i zdalnym dostępie do systemów. Takie podejście zapewnia elastyczność i wydajność, umożliwiając przeprowadzanie audytów niezależnie od odległości geograficznych i ograniczeń w podróżowaniu. Aby jednak zapewnić skuteczność zdalnych audytów, należy zająć się takimi wyzwaniami, jak ograniczona bezpośrednia obserwacja obiektów i potencjalne obawy związane z cyberbezpieczeństwem.
Pomimo różnic, cele zarówno zdalnych, jak i tradycyjnych audytów pozostają takie same - weryfikacja zgodności, identyfikacja obszarów wymagających poprawy oraz zapewnienie jakości i bezpieczeństwa produktów farmaceutycznych. Wybór między audytem zdalnym a audytem na miejscu zależy od takich czynników, jak charakter audytu, wymogi regulacyjne i możliwości firmy w zakresie ułatwienia dokładnej oceny za pomocą środków zdalnych.
Freyr dziesięcioletnie doświadczenie, aby zapewnić niezrównane rozwiązania regulacyjne, gwarantujące zgodność z przepisami i sukces w dynamicznym środowisku farmaceutycznym.
Odkryj doskonałość regulacyjną wraz z us Twoim strategicznym partnerem w zakresie zgodności z przepisami w nieustannie zmieniającej się branży farmaceutycznej. Skontaktuj się z us płynnie poruszać się po zawiłościach regulacyjnych.
Jakie wyzwania mogą pojawić się podczas zdalnych audytów i jak sobie z nimi poradzić, aby zapewnić dokładną ocenę?
Podczas zdalnych audytów może pojawić się kilka wyzwań, ale organizacje mogą podjąć kroki, aby im sprostać i zapewnić dokładną ocenę. Oto kilka kluczowych wyzwań i ich potencjalnych rozwiązań:
- Budowanie kluczowych relacji z interesariuszami audytu:
- Wyzwanie: Praca zdalna może utrudniać rozwój silnych relacji z interesariuszami audytu.
- Rozwiązanie: Regularne wirtualne spotkania, otwarta komunikacja i aktywne zaangażowanie mogą pomóc w budowaniu i utrzymywaniu relacji. Użyj połączeń wideo, aby nawiązać osobistą więź.
- Inwestowanie w technologię do pracy wirtualnej:
- Wyzwanie: Zdalne audyty w dużej mierze opierają się na technologii, a nieodpowiednie narzędzia mogą ograniczać wydajność.
- Rozwiązanie: Zainwestuj w solidne oprogramowanie do zarządzania audytami, bezpieczne platformy komunikacyjne i narzędzia do współpracy. Zapewnienie audytorom niezbędnego sprzętu i oprogramowania.
- Rozwój pracowników i promowanie pozytywnej kultury zdalnie:
- Wyzwanie: Praca zdalna może prowadzić do izolacji i utrudniać rozwój zawodowy.
- Rozwiązanie: Zapewnienie wirtualnych szkoleń, mentoringu i możliwości rozwoju umiejętności. Wspieranie pozytywnej kultury poprzez działania budujące zespół, uznanie i regularne kontrole.
- Kultywowanie celowego i adaptacyjnego sposobu myślenia:
- Wyzwanie: Zdalni audytorzy muszą dostosowywać się do zmieniających się okoliczności i zachować koncentrację.
- Rozwiązanie: Zachęcanie do elastyczności, zdolności adaptacyjnych i nastawienia na rozwój. Szkolenie audytorów w zakresie radzenia sobie z nieoczekiwanymi sytuacjami i dostosowywania ich podejścia w razie potrzeby.
Freyr zaufanym partnerem w zakresie zgodności z przepisami i rozwiązań bezpieczeństwa dla branży nauk przyrodniczych. Dzięki dogłębnej wiedzy specjalistycznej, innowacyjnej technologii i globalnemu zasięgowi, Freyr organizacjom płynne poruszanie się po złożonym środowisku regulacyjnym. Zapoznaj się z naszymi usługami i skontaktuj się us , aby usprawnić proces zapewniania zgodności z przepisami.
W jaki sposób Freyr może Freyr pomóc Państwu w przeprowadzaniu audytów zdalnych?
Freyr, dzięki dziesięcioletniemu doświadczeniu, wyróżnia się w usprawnianiu płynnych audytów zdalnych dla branży farmaceutycznej. Wykorzystując zaawansowane technologie i dogłębną znajomość wymogów regulacyjnych, Freyr dokładny i wydajny proces audytu, rozwiązując takie wyzwania, jak ograniczona obecność fizyczna i kwestie związane z cyberbezpieczeństwem.
Nasz wyspecjalizowany zespół ekspertów ds. regulacji jest biegły w wykorzystywaniu innowacyjnych rozwiązań cyfrowych, zapewniając kompleksową wirtualną ocenę procesów, obiektów i dokumentacji. Nasze sprawdzone osiągnięcia w zakresie audytów zdalnych odzwierciedlają nasze zaangażowanie w dostarczanie niezawodnych i skutecznych rozwiązań regulacyjnych dostosowanych do zmieniających się potrzeb branży farmaceutycznej. Dzięki Freyr zyskujesz zaufanego partnera, który rozumie zawiłości audytów zdalnych i stosuje proaktywne i oparte na współpracy podejście, aby usprawnić proces zapewniania zgodności z przepisami.
Czym jest walidacja systemu komputerowego (CSV) i dlaczego ma ona kluczowe znaczenie w branży farmaceutycznej?
Walidacja systemów komputerowych (CSV) jest krytycznym procesem w przemyśle farmaceutycznym, który zapewnia integralność, niezawodność i zgodność systemów komputerowych wykorzystywanych do różnych celów. Zagłębmy się w szczegóły:
- Definicja i cel:
- CSV to udokumentowany proces, który zapewnia, że system komputerowy będzie generował informacje lub dane spełniające wcześniej zdefiniowane wymagania.
- Jego głównym celem jest walidacja i weryfikacja, czy systemy komputerowe konsekwentnie działają zgodnie z przeznaczeniem, zachowując dokładność, niezawodność i bezpieczeństwo danych.
- Znaczenie w branży farmaceutycznej:
- Zgodność z przepisami: Branża farmaceutyczna działa zgodnie z surowymi przepisami (takimi jak Dobra Praktyka Wytwarzania lub GMP) w celu zapewnienia jakości, bezpieczeństwa i skuteczności produktów.
- Integralność danych: Dokładne i wiarygodne dane mają kluczowe znaczenie dla opracowywania leków, badań klinicznych, produkcji i dystrybucji.
- Ograniczanie ryzyka: CSV pomaga identyfikować i ograniczać ryzyko związane z systemami komputerowymi, zapobiegając błędom, utracie danych i niezgodności z przepisami.
- Bezpieczeństwo pacjentów: Odpowiednio zweryfikowane systemy przyczyniają się do bezpieczeństwa pacjentów, zapewniając stałą jakość i zgodność ze standardami.
- Kluczowe aspekty CSV:
- Definicja wymagań: Jasne zdefiniowanie wymagań systemowych, funkcjonalności i oczekiwań użytkowników.
- Projektowanie i konfiguracja: Opracowanie i konfiguracja systemu zgodnie ze specyfikacją.
- Testowanie i kwalifikacja: Rygorystyczne testy (w tym testy jednostkowe, testy integracyjne i testy akceptacyjne użytkownika) w celu weryfikacji wydajności systemu.
- Dokumentacja: Prowadzenie kompleksowej dokumentacji przez cały cykl życia systemu.
- Kontrola zmian: Zarządzaj zmianami w systemie, upewniając się, że nie zagrażają one jego integralności.
- Wyzwania podjęte przez CSV:
- Integralność danych: Zapobieganie nieautoryzowanemu dostępowi, uszkodzeniu danych lub manipulacjom.
- Bezpieczeństwo systemu: Ochrona przed cyberzagrożeniami i nieautoryzowanymi modyfikacjami.
- Ścieżka audytu: Prowadzenie nieusuwalnej elektronicznej ścieżki danych na potrzeby audytów regulacyjnych.
- Konserwacja walidacji: Regularny przegląd i aktualizacja walidacji w celu dostosowania do zmian w systemie.
Czym różni się CSV od Computer System Assurance (CSA)?
Computer System Validation (CSV) i Computer System Assurance (CSA) reprezentują różne podejścia do zapewnienia integralności i zgodności systemów komputerowych w przemyśle farmaceutycznym. CSV, wieloletnia praktyka, koncentruje się przede wszystkim na fazie walidacji cyklu życia systemu, zapewniając, że systemy oprogramowania spełniają wymogi regulacyjne za pomocą predefiniowanych protokołów. Z drugiej strony, CSA przyjmuje bardziej ekspansywne i dynamiczne podejście, obejmujące cały cykl życia skomputeryzowanego systemu, od opracowania i wdrożenia po użytkowanie operacyjne i ostateczne wycofanie.
CSV odpowiada na potrzebę rygorystycznych procesów walidacji, kładąc nacisk na podejście oparte na ryzyku w celu identyfikacji i łagodzenia potencjalnych problemów. Jednak rynek farmaceutyczny ewoluuje, co doprowadziło do pojawienia się CSA jako bardziej kompleksowej strategii. CSA wykracza poza walidację, dostosowując zwinne metodologie i włączając ciągłe monitorowanie w całym cyklu życia systemu. Ta holistyczna perspektywa pozwala organizacjom proaktywnie zarządzać ryzykiem, zwłaszcza w zakresie cyberbezpieczeństwa i integralności danych, dostosowując się do rosnącego nacisku branży na technologię i bezpieczeństwo danych.
Możliwość adaptacji CSA jest cenna w szybko zmieniającym się środowisku regulacyjnym. Podczas gdy CSV przestrzega tradycyjnych praktyk walidacji, CSA dostosowuje się do zmieniających się oczekiwań organów regulacyjnych. Wykracza poza okresowe wysiłki związane z walidacją, obejmując ciągłe monitorowanie, analizę danych w czasie rzeczywistym i proaktywne strategie zarządzania ryzykiem w celu zapewnienia ciągłej zgodności i optymalnej wydajności. W miarę jak przemysł farmaceutyczny obejmuje transformację cyfrową, zrozumienie niuansów między CSV i CSA staje się niezbędne dla firm dążących do utrzymania przewagi w zakresie zgodności z przepisami i integralności systemu.
W tym kontekście Freyr, dzięki bogatemu doświadczeniu i wiedzy specjalistycznej, jest dobrze przygotowana do wspierania firm farmaceutycznych w zakresie złożonych zagadnień związanych zarówno z CSV, jak i CSA, oferując dostosowane do indywidualnych potrzeb rozwiązania, które spełniają zmieniające się wymagania w zakresie zgodności z przepisami i postępu technologicznego.
Jakie są składniki programu CSA?
Computer Software Assurance (CSA) to nowoczesne podejście, które zwiększa niezawodność, bezpieczeństwo i zgodność systemów komputerowych. Przyjrzyjmy się jego składnikom i długoterminowym korzyściom:
- Podejście oparte na ryzyku:
- Komponent: CSA koncentruje się na ocenie i zarządzaniu ryzykiem.
- Znaczenie: Identyfikacja krytycznych obszarów pomaga efektywnie alokować wysiłki związane z walidacją.
- Testowanie bez skryptów:
- Komponent: CSA obejmuje nieskryptowane testy wykraczające poza tradycyjne przypadki testowe.
- Znaczenie: Nieskryptowane testy naśladują rzeczywiste scenariusze, odkrywając ukryte problemy.
- Ciągłe monitorowanie wydajności:
- Komponent: CSA obejmuje bieżące monitorowanie wydajności systemu.
- Znaczenie: Wczesne wykrywanie anomalii zapobiega awariom systemu i problemom z integralnością danych.
- Nadzór nad danymi:
- Komponent: CSA kładzie nacisk na jakość i integralność danych.
- Znaczenie: Zapewnia dokładne dane do podejmowania decyzji i zgodności z przepisami.
- Działania związane z walidacją zewnętrzną:
- Komponent: CSA współpracuje z dostawcami oprogramowania w celu zewnętrznej walidacji.
- Znaczenie: Niezależna walidacja zwiększa zaufanie i zmniejsza stronniczość.
- Przejście z CSV na CSA:
- Kroki początkowe:
- Zrozumienie zasad CSA.
- Ocena istniejących systemów pod kątem ryzyka.
- Ustal priorytety krytycznych funkcji.
- Korzyści:
- Zmniejszone obciążenie związane z walidacją.
- Zwinna reakcja na zmiany.
- Zwiększona niezawodność systemu.
- Kroki początkowe:
- Długoterminowa niezawodność systemu:
- CSA zapewnia:
- Zdolność adaptacji: Systemy ewoluują bez uszczerbku dla niezawodności.
- Bezpieczeństwo: Ochrona przed zagrożeniami cybernetycznymi.
- Zgodność z przepisami: Ciągłe dostosowywanie się do przepisów.
- Jakość: Spójne dane i jakość produktu.
- CSA zapewnia:
W jaki sposób CSA przyczynia się do integralności danych w branży farmaceutycznej?
CSA stoi na straży integralności danych w branży farmaceutycznej, zapewniając dokładność, spójność i wiarygodność danych w całym cyklu życia systemu. W przeciwieństwie do tradycyjnych podejść, CSA przyjmuje holistyczną strategię, która wykracza poza walidację, aktywnie zajmując się potencjalnymi wyzwaniami i rozbieżnościami, które mogą pojawić się z czasem.
Jednym z wkładów CSA w integralność danych są możliwości ciągłego monitorowania. Zamiast polegać wyłącznie na okresowych działaniach walidacyjnych, CSA obejmuje analizę danych w czasie rzeczywistym i proaktywne środki zarządzania ryzykiem. Takie podejście umożliwia organizacjom wykrywanie i rozwiązywanie potencjalnych rozbieżności w danych, zapobiegając gromadzeniu się nieścisłości w czasie. Nacisk CSA na dynamiczny i adaptacyjny model cyklu życia zapewnia, że integralność danych pozostaje w stałym centrum uwagi, zgodnie z oczekiwaniami organów regulacyjnych.
Aby zapobiec rozbieżnościom danych w czasie, CSA stosuje kilka strategicznych środków. Po pierwsze, stosuje solidne procesy kontroli zmian, skrupulatnie dokumentując wszelkie modyfikacje systemów komputerowych lub procesów, które mogą mieć wpływ na integralność danych. Przeprowadzane są regularne audyty i oceny systemów w celu zidentyfikowania i naprawienia potencjalnych problemów przed ich eskalacją. CSA podkreśla również znaczenie szkoleń i programów uświadamiających dla użytkowników, aby zapewnić, że personel rozumie znaczenie utrzymania integralności danych i przestrzega najlepszych praktyk.
Podsumowując, proaktywne i kompleksowe podejście CSA do integralności danych wyróżnia ją jako strategiczne rozwiązanie w branży farmaceutycznej. Dzięki ciągłemu monitorowaniu, zarządzaniu ryzykiem i rygorystycznym środkom kontroli zmian, CSA utrzymuje integralność danych i zapewnia, że firmy farmaceutyczne są dobrze przygotowane do poruszania się w zmieniającym się krajobrazie oczekiwań regulacyjnych. Ponieważ organizacje dążą do utrzymania najwyższych standardów w zakresie integralności danych, CSA staje się kluczowym sojusznikiem w ich podróży, dostosowując się do trendów branżowych i postępów regulacyjnych.
Dla organizacji poszukujących wskazówek dotyczących wdrażania skutecznych strategii CSA, Freyr niezawodnym partnerem oferującym dostosowane do indywidualnych potrzeb rozwiązania, które pozwalają sprostać wyjątkowym wyzwaniom branży farmaceutycznej.
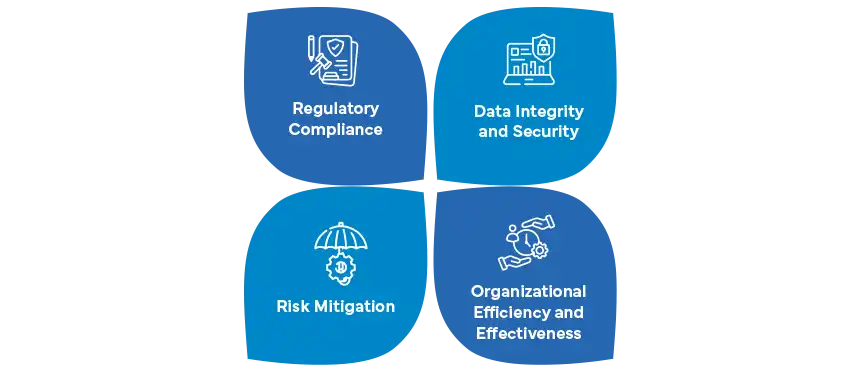
Jaką rolę w CSA odgrywa zgodność z przepisami?
Zgodność z przepisami jest kamieniem węgielnym CSA, zapewniając firmom farmaceutycznym przestrzeganie zmieniających się standardów i wytycznych w całym cyklu życia systemu. W przeciwieństwie do tradycyjnej walidacji systemów komputerowych (CSV), CSA kładzie nacisk na ciągłą zgodność i zdolność adaptacji do zmieniających się krajobrazów regulacyjnych. W miarę jak firmy przechodzą od CSV do CSA, bycie na bieżąco ze zmieniającymi się przepisami staje się najważniejsze.
W kontekście CSA, zgodność z przepisami obejmuje dostosowanie skomputeryzowanych systemów do globalnych i lokalnych wymogów regulacyjnych od etapu rozwoju, poprzez użytkowanie operacyjne, aż po ostateczne wycofanie. CSA kładzie nacisk na ciągłą zgodność, a nie okresową walidację, wspierając proaktywne podejście do szybkiego reagowania na potencjalne zmiany regulacyjne. Takie strategiczne dostosowanie zapewnia, że firmy farmaceutyczne są dobrze przygotowane do spełnienia oczekiwań organów regulacyjnych, chroniąc integralność danych, bezpieczeństwo pacjentów i ogólną niezawodność systemu.

Regularne kontakty z organami regulacyjnymi, udział w forach branżowych oraz subskrypcja publikacji regulacyjnych zapewniają cenne informacje na temat zmieniających się standardów. Wykorzystanie wiedzy specjalistycznej konsultantów ds. regulacji oraz inwestowanie w ciągłe szkolenia personelu zaangażowanego w procesy CSA dodatkowo zwiększa świadomość regulacyjną. Współpraca z partnerami regulacyjnymi, takimi jak Freyr Solutions, zapewnia proaktywne podejście, gwarantując dostęp do aktualnych informacji regulacyjnych i dostosowanych rozwiązań, które pozwalają płynnie przejść przez proces transformacji.
Zgodność z przepisami w CSA to dynamiczne i ciągłe zobowiązanie, które jest zgodne ze zmianą branży w kierunku zdolności adaptacyjnych i ciągłego doskonalenia. Bycie na bieżąco, proaktywność i współpraca z ekspertami ds. regulacji mają kluczowe znaczenie dla firm przechodzących z CSV na CSA, ułatwiając płynną i zgodną z przepisami ewolucję w stale zmieniającym się krajobrazie farmaceutycznym.
Jako zaufany partner w zakresie regulacji prawnych, Freyr niezbędne wsparcie i wiedzę specjalistyczną, aby pomóc firmom przejść przez ten proces transformacji, zapewniając doskonałość regulacyjną i zgodność z przepisami w era .
W jaki sposób pomaga strategiczny partner ds. zgodności z przepisami?
Strategiczny partner w zakresie zgodności z przepisami odgrywa kluczową rolę w zapewnieniu, że firmy farmaceutyczne spełniają wymogi prawne i utrzymują wysokie standardy jakości. Oto jak mogą pomóc:
- Porady ekspertów: Partner strategiczny zapewnia porady ekspertów w zakresie poruszania się po złożonych i zmieniających się przepisach w różnych regionach. Oferują wgląd w najnowsze zmiany regulacyjne, pomagając firmom dostosować swoje praktyki i zachować zgodność.
- Usprawnione procesy: Pomagają usprawnić procesy zgodności poprzez wdrażanie najlepszych praktyk i wydajnych przepływów pracy. Obejmuje to opracowanie solidnych systemów dokumentacji, audytu i walidacji, zmniejszenie obciążeń administracyjnych i poprawę ogólnej wydajności.
- Ograniczanie ryzyka: Identyfikując potencjalne zagrożenia i luki w zakresie zgodności, partner strategiczny pomaga ograniczyć ryzyko, zanim stanie się ono problemem. Przeprowadzają oni dokładne audyty i oceny, aby upewnić się, że wszystkie procesy są zgodne z przepisami i proaktywnie eliminują wszelkie luki.
- Szkolenia i wsparcie: Oferują szkolenia i wsparcie, aby zapewnić, że pracownicy są dobrze poinformowani o wymaganiach regulacyjnych i najlepszych praktykach. Pomaga to budować wewnętrzne kompetencje i zapewnia, że wszyscy zaangażowani w działania związane ze zgodnością są na bieżąco z aktualnymi standardami.
- Integracja technologii: Partner strategiczny pomaga w integracji innowacyjnych technologii, takich jak automatyzacja i sztuczna inteligencja, z procesami zgodności. Zapewnia, że technologie te są wdrażane skutecznie i zgodnie z wymogami regulacyjnymi, zwiększając integralność danych i wydajność procesów.
- Dokumentacja i prowadzenie rejestrów: Zarządzają tworzeniem, organizacją i utrzymaniem kluczowej dokumentacji zgodności. Zapewnia to, że wszystkie zapisy są dokładne, kompletne i łatwo dostępne na potrzeby audytów i inspekcji.
- Zgłoszenia i zatwierdzenia regulacyjne: Zajmują się przygotowywaniem i składaniem dokumentów i wniosków regulacyjnych. Obejmuje to zapewnienie, że złożone dokumenty spełniają wszystkie niezbędne wymagania i zarządzanie komunikacją z organami regulacyjnymi w celu ułatwienia terminowego zatwierdzania.
- Działania naprawcze i zapobiegawcze: Partner strategiczny wspiera opracowywanie i wdrażanie działań naprawczych i zapobiegawczych w odpowiedzi na ustalenia audytu lub kwestie zgodności. Pomaga zapewnić, że działania te są skuteczne i nie zakłócają bieżącej działalności.
- Globalna strategia zgodności: Opracowują i wdrażają strategie osiągania globalnej zgodności, odnosząc się do zróżnicowanych wymogów regulacyjnych różnych rynków. Gwarantuje to, że produkty spełniają wszystkie standardy niezbędne do międzynarodowej dystrybucji i użytkowania.
- Bieżące monitorowanie: Zapewniają bieżące monitorowanie i wsparcie, aby informować firmy o wszelkich aktualizacjach lub zmianach w przepisach. To proaktywne podejście pomaga firmom zachować zgodność z przepisami i dostosowywać się do nowych regulacji w miarę ich pojawiania się.
Dlaczego warto wybrać Freyr?
Ponad dziesięć lat doskonałości w zakresie zgodności z przepisami.
Pełne spektrum zgodności, audytu i walidacji.
Doświadczenie w różnych branżach i obszarach geograficznych.
Wykorzystuje innowacyjne narzędzia do uzyskiwania dokładnych wyników.
Wykwalifikowani profesjonaliści z dogłębną wiedzą branżową.
Skuteczne zarządzanie złożonymi wyzwaniami w zakresie zgodności.
Często zadawane pytania
Zgodność farmaceutyczna obejmuje przestrzeganie przepisów prawa, regulacji i wytycznych, które regulują branżę farmaceutyczną. Zapewnia to, że firmy dostosowują swoje działania do standardów branżowych, chroniąc w ten sposób bezpieczeństwo i skuteczność produktów przy jednoczesnym zachowaniu integralności danych.
Celem audytu jest systematyczna ocena zgodności firmy z normami regulacyjnymi i wewnętrznymi zasadami. Audyty pomagają zidentyfikować obszary wymagające poprawy, ograniczyć ryzyko i zapewnić, że procesy są skuteczne w wytwarzaniu bezpiecznych i zgodnych z przepisami produktów farmaceutycznych.
Walidacja w branży farmaceutycznej to proces potwierdzania, że systemy, procesy i sprzęt konsekwentnie spełniają wcześniej zdefiniowane wymagania. Ma ona zasadnicze znaczenie dla zapewnienia zgodności z normami regulacyjnymi oraz utrzymania jakości i bezpieczeństwa produktów farmaceutycznych w całym cyklu ich życia.
Procesy te mają kluczowe znaczenie dla zapewnienia bezpieczeństwa i skuteczności produktów, utrzymania zgodności z przepisami, poprawy zapewnienia jakości, wspierania dostępu do rynku i ułatwiania ciągłego doskonalenia. Pomagają one firmom spełniać rygorystyczne standardy i budować zaufanie wśród interesariuszy.
Wyzwania obejmują poruszanie się po zmieniających się przepisach, zapewnianie integralności danych, zarządzanie ograniczeniami zasobów i prowadzenie odpowiedniej dokumentacji. Ponadto integracja innowacyjnych technologii i zapewnienie kompetencji personelu może skomplikować wysiłki w zakresie zgodności.
Audyty GxP to oceny przeprowadzane w celu zapewnienia zgodności z normami dobrych praktyk (GxP), które obejmują dobre praktyki wytwarzania (GMP), dobre praktyki kliniczne (GCP) oraz dobre praktyki laboratoryjne (GLP). Audyty te pomagają zidentyfikować luki w zgodności i ulepszyć systemy jakości.
Niezależny audyt zgodności GxP to obiektywna ocena przestrzegania przez firmę norm jakościowych i regulacyjnych. Przeprowadzany przez wykwalifikowanych audytorów, identyfikuje ryzyko i obszary wymagające poprawy, zwiększając zgodność i bezpieczeństwo produktów.
Audyty GxP zapewniają bezstronne oceny, zwiększają zgodność z przepisami i identyfikują obszary wymagające poprawy operacyjnej. Pomagają utrzymać standardy wysokiej jakości i budować zaufanie organów regulacyjnych i klientów.
CSV zapewnia, że skomputeryzowane systemy stosowane w branży farmaceutycznej konsekwentnie generują wiarygodne dane i spełniają wymogi regulacyjne. Ma to kluczowe znaczenie dla zachowania integralności danych, ograniczenia ryzyka i zapewnienia bezpieczeństwa pacjentów w całym cyklu życia produktu.
CSV koncentruje się na sprawdzeniu, czy system spełnia wymagania prawne i działa zgodnie z przeznaczeniem, podczas gdy CSA obejmuje szersze podejście, które obejmuje ciągłe zapewnianie wydajności i zgodności systemu w całym jego cyklu życia.










