Często zadawane pytania
Sprawy regulacyjne RA) w branży farmaceutycznej obejmują zapewnienie jakości, bezpieczeństwa i skuteczności leków w całym cyklu ich życia. RA zajmują się złożonymi wymogami światowych organów ds. zdrowia, dbając o zgodność z przepisami od momentu odkrycia leku aż po jego wprowadzenie na rynek. Pełnią oni rolę łącznika między firmami farmaceutycznymi a organami regulacyjnymi na całym świecie.
Podstawowym celem regulacji w przemyśle farmaceutycznym jest ochrona zdrowia publicznego poprzez zapewnienie, że nowe leki są bezpieczne i skuteczne, zanim trafią na rynek. Agencje regulacyjne egzekwują rygorystyczne standardy testowania i oceny, minimalizując potencjalne zagrożenia dla zdrowia. Ten nadzór regulacyjny zapewnia zaufanie do terapii medycznych dostępnych dla społeczeństwa.
Sprawy regulacyjne dbają o to, aby produkty farmaceutyczne były zgodne z normami regulacyjnymi przez cały cykl życia. Angażują się w projektowanie badań klinicznych, Pozwolenie na dopuszczenie do obrotu produktu leczniczego oraz zarządzanie po uzyskaniu pozwolenia, zapewniając stałą zgodność z przepisami i ułatwiając wprowadzanie niezbędnych zmian w produktach. Ich wiedza specjalistyczna pomaga firmom w skutecznym wprowadzaniu na rynek bezpiecznych i skutecznych produktów.
Zarządzanie cyklem życia produktów farmaceutycznych obejmuje utrzymanie rentowności produktu od momentu opracowania do momentu uzyskania pozwolenia na dopuszczenie do obrotu. Obejmuje ono strategie rozwoju klinicznego, Pozwolenie na dopuszczenie do obrotu produktu leczniczego oraz stałą zgodność z normami regulacyjnymi. Skuteczne zarządzanie cyklem życia produktu gwarantuje jego bezpieczeństwo i skuteczność przez cały okres obecności na rynku.
Regulacje farmaceutyczne przeszły znaczną ewolucję, od średniowiecznych wykazów leków po współczesne działania na rzecz harmonizacji międzynarodowej. Do kluczowych kamieni milowych należą US ustawa US Food and Drugs Act z 1906 r. oraz utworzenie Międzynarodowej Konferencji ds. Harmonizacji (ICH) w 1990 r. Zmiany te przyczyniły się do wzmocnienia globalnych standardów bezpieczeństwa i skuteczności leków.
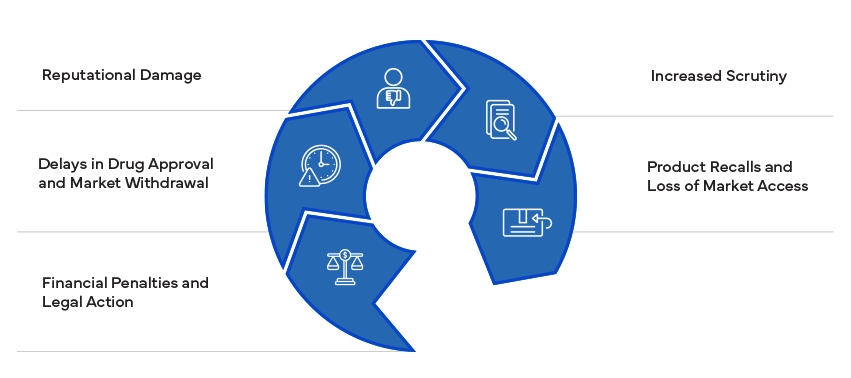
Niezgodność ze standardami regulacyjnymi może prowadzić do poważnych konsekwencji, w tym grzywien, sporów sądowych i wycofania produktów. Może to zaszkodzić reputacji firmy i skutkować zwiększoną kontrolą ze strony organów regulacyjnych. Zapewnienie zgodności ma zasadnicze znaczenie dla uniknięcia tego ryzyka i utrzymania dostępu do rynku.
Freyr oferuje kompleksowe rozwiązania regulacyjne, wspierając klientów od wczesnego etapu rozwoju po komercjalizację. Ich usługi obejmują przygotowanie dokumentacji dla organów ochrony zdrowia, identyfikację wyzwań regulacyjnych i doradztwo w zakresie strategii po wprowadzeniu produktu na rynek. Doświadczenie Freyr pomaga przyspieszyć rozwój produktu i jego dostępność na rynku.
Globalna harmonizacja przepisów ma na celu usprawnienie procesów opracowywania i rejestracji leków w różnych krajach. Minimalizuje ona testy na zwierzętach i zapewnia zdrowie publiczne poprzez ujednolicenie wymogów regulacyjnych w skali międzynarodowej. Harmonizacja ta ułatwia skuteczne wprowadzanie nowych terapii na rynki globalne.
Agencje regulacyjne, takie jak FDA w Stanach Zjednoczonych i EMA w Unii Europejskiej, egzekwują standardy w celu zapewnienia bezpieczeństwa i skuteczności leków. Nadzorują one kompleksowe procesy testowania i oceny przed wprowadzeniem leków na rynek. Agencje te równoważą potrzebę nowych metod leczenia z minimalizacją potencjalnych zagrożeń dla zdrowia.
Global Regulatory intelligence firmy Freyr zapewnia aktualne informacje na temat globalnych przepisów i stanowisk organów ds. zdrowia. Ramy te są zintegrowane z projektami klientów w celu zwiększenia sukcesu rynkowego. Wspiera planowanie strategiczne i zgodność z przepisami w wielu regionach geograficznych.