Globalne Regulatory Labeling Services farmaceutycznego
Wykorzystaj dziesięcioletnie doświadczenie dzięki naszym Regulatory Labeling services, obejmującym nowe zezwolenia na produkty, zgłoszenia do organów ds. zdrowia, po zatwierdzeniu, CMC i zarządzanie cyklem życia. Nasza koncentracja na globalnej i lokalnej doskonałości zapewnia strategiczne tworzenie i aktualizacje niezbędnych dokumentów dotyczących etykietowania, takich jak IB, CDS i CCDS, gwarantując zgodność i sukces w branży farmaceutycznej.
Przeglądaj tematy
- Czym jest etykietowanie regulacyjne?
- Dlaczego oznakowanie regulacyjne jest ważne w branży farmaceutycznej?
- Jak wygląda proces zatwierdzania etykiet?
- Jakie są typowe wyzwania związane z etykietowaniem regulacyjnym?
- Jakie są kluczowe przepisy regulujące etykietowanie produktów farmaceutycznych?
- W jaki sposób partner regulacyjny może pomóc w osiągnięciu zgodności z wymogami dotyczącymi etykietowania?
- Jak firmy mogą rozpocząć korzystanie z Regulatory Labeling Services?
- Czy Regulatory Labeling Services mogą pomóc w monitorowaniu po wprowadzeniu do obrotu?
- Dlaczego warto wybrać Freyr?
- Nasze usługi
Czym jest etykietowanie regulacyjne?
Ostatnia aktualizacja na: Sierpień, 2024
Etykietowanie farmaceutyczne obejmuje tworzenie, przegląd i zarządzanie kluczowymi dokumentami, które przekazują istotne informacje o produkcie zainteresowanym stronom, zapewniając zgodność z globalnymi standardami regulacyjnymi. Podstawowe elementy obejmują arkusz danych podstawowychCDS) i arkusz danych podstawowych firmyCCDS), pochodzące ze źródeł takich jak broszury badawcze i dane po wprowadzeniu do obrotu. Proces ten odgrywa kluczową rolę w przekazywaniu informacji dotyczących bezpieczeństwa i skuteczności na etykietach specyficznych dla danego kraju oraz w dostosowywaniu się do wymogów Health Authority (HA) .
Koncentrując się na globalnej harmonizacji, farmaceutyczne etykiety regulacyjne spełniają zmieniające się wymagania regulacyjne, obejmujące nowe zezwolenia na produkty, zgłoszenia HA, zatwierdzenia i zarządzanie cyklem życia. Precyzja i przestrzeganie zmieniających się wytycznych mają kluczowe znaczenie dla skutecznego oznakowania regulacyjnego produktów farmaceutycznych, wpływając na dopuszczenie produktu do obrotu, profil bezpieczeństwa i ogólną rentowność regulacyjną.

Freyr, lider w Regulatory labeling services end-to-end Regulatory labeling services end-to-end , dysponuje wyspecjalizowanym zespołem ponad 180 ekspertów ds. etykietowania z całego świata, którzy specjalizują się w sporządzaniu kluczowych dokumentów, takich jak broszury badawcze (IB), arkusze danych podstawowych dotyczących rozwoju oraz podstawowe informacje dotyczące bezpieczeństwa rozwoju. Wykorzystanie sztucznej inteligencji zwiększa dokładność i przyspiesza wdrażanie oraz weryfikację arkuszy danych. Dzięki usprawnionemu CCDS i precyzyjnym procesom kompleksowe usługi Freyr skutecznie zaspokajają dynamiczne potrzeby branży farmaceutycznej, zapewniając niezrównane wsparcie w zakresie zgodności etykietowania i sukcesu regulacyjnego.
Dlaczego oznakowanie regulacyjne jest ważne w branży farmaceutycznej?
- Zapewnienie bezpieczeństwa pacjentów i przekazywanie informacji: Etykiety regulacyjne mają kluczowe znaczenie dla bezpieczeństwa pacjentów. Etykiety dostarczają istotnych informacji na temat stosowania leków, dawkowania, skutków ubocznych i przeciwwskazań. Pacjenci, lekarze przepisujący leki, pracownicy służby zdrowia i opiekunowie polegają na tych etykietach przy podejmowaniu świadomych decyzji. Jasne i dokładne etykiety zmniejszają ryzyko błędów w stosowaniu leków, zdarzeń niepożądanych i niewłaściwego użycia.
Zapewnia to, że pacjenci otrzymują właściwe leczenie i rozumieją jego prawidłowe stosowanie. Ponadto organy regulacyjne wymagają, aby każdy produkt farmaceutyczny na rynku posiadał etykietę w celu skutecznego przekazywania informacji o leczeniu. - Zgodność z przepisami i ograniczanie ryzyka: Zgodność z przepisami dotyczącymi etykietowania nie jest tylko formalnością, ale wymogiem prawnym. Organy regulacyjne, takie jak US Agencja US i Leków (FDA), Europejska Agencja Leków (EMA) i inne, wymagają dokładnego i kompleksowego etykietowania. Niezgodność z przepisami może skutkować karami regulacyjnymi, utratą reputacji marki, a nawet tymczasowym wstrzymaniem produkcji. Firmy farmaceutyczne muszą wykazać, że ich procesy, metody, testy i sprzęt związane z etykietowaniem są w stanie zapewnić stałą produkcję bezpiecznych i skutecznych produktów. Prawidłowo zweryfikowane etykietowanie ogranicza ryzyko i zapewnia zgodność z dobrymi praktykami wytwarzania (GMP).
- Dostęp do rynku i globalna harmonizacja: Dobrze skonstruowane etykiety ułatwiają dostęp do globalnego rynku. Spójne etykietowanie w różnych regionach usprawnia procesy, redukuje nadmiarowość i jest zgodne ze zharmonizowanymi standardami. W miarę jak międzynarodowe organy regulacyjne przyjmują wymogi walidacji GMP, w tym serializacji, łańcuchy dostaw farmaceutycznych stają w obliczu rosnącej złożoności. Firmy, które priorytetowo traktują zgodność etykiet, budują zaufanie, zwiększają akceptację rynku i zapewniają sobie sukces w konkurencyjnym krajobrazie.
Jak wygląda proces zatwierdzania etykiet?
Proces zatwierdzania etykiet w branży farmaceutycznej obejmuje wiele etapów, aby zapewnić, że wszystkie informacje związane z lekiem są dokładne, zgodne i jasne zarówno dla świadczeniodawców, jak i pacjentów. Rozpoczyna się od opracowania treści etykiety, która zawiera szczegóły dotyczące dawkowania, podawania, bezpieczeństwa i ostrzeżeń. Następnie zespoły regulacyjne i medyczne dokonują wewnętrznego przeglądu tego projektu, aby upewnić się, że jest on zgodny z lokalnymi i międzynarodowymi standardami regulacyjnymi. Po sfinalizowaniu etykieta jest przedkładana organom ds. zdrowia do zatwierdzenia, gdzie przechodzi rygorystyczną kontrolę w celu zweryfikowania jej zgodności z wymogami bezpieczeństwa i skuteczności. Dopiero po otrzymaniu oficjalnego zatwierdzenia etykieta może zostać wykorzystana do wprowadzenia leku na rynek.
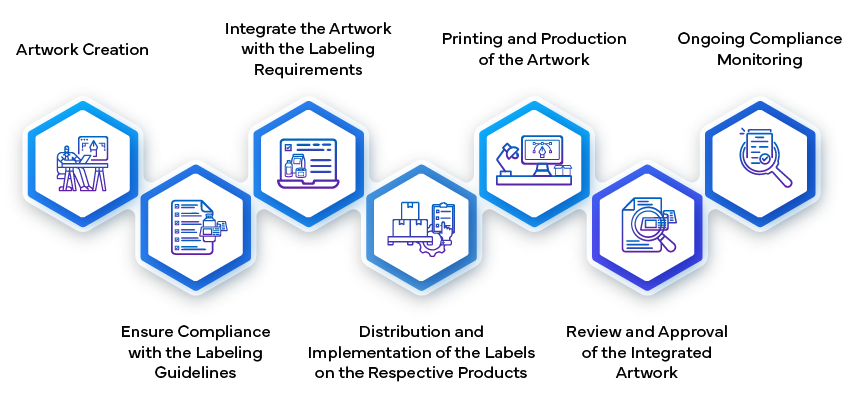
- Tworzenie i przesyłanie etykiety:
- Wstępne gromadzenie danych: Firmy farmaceutyczne gromadzą wszystkie istotne dane na potrzeby etykiety leku. Obejmuje to informacje na temat skuteczności, bezpieczeństwa, dawkowania, wskazań, przeciwwskazań i potencjalnych zagrożeń. Etykieta służy jako kluczowe narzędzie komunikacji dla pracowników służby zdrowia i pacjentów.
- Przedłożenie organom regulacyjnym: Firma przedkłada dane dotyczące etykiety organom regulacyjnym, takim jak US Agencja US i Leków (FDA) lub Europejska Agencja Leków (EMA). Agencje te oceniają dane, aby upewnić się, że korzyści płynące ze stosowania leku przewyższają znane i potencjalne ryzyko dla docelowej populacji.
- Analiza kontekstowa: Recenzenci analizują docelowy stan lub chorobę, na którą lek jest przeznaczony. Biorą pod uwagę istniejące możliwości leczenia, porównując ryzyko związane z lekiem z jego korzyściami. Na przykład lek stosowany w leczeniu choroby zagrażającej życiu, dla której nie ma alternatywnej terapii, może zostać zatwierdzony, nawet jeśli ryzyko byłoby niedopuszczalne w przypadku choroby niezagrażającej życiu.
- Ocena danych klinicznych: Recenzenci FDA oceniają informacje o korzyściach klinicznych i ryzyku przedstawione przez producenta leku. Uwzględniają oni wszelkie niepewności wynikające z niedoskonałych lub niekompletnych danych. Zazwyczaj agencja oczekuje wyników dobrze zaprojektowanych badań klinicznych w celu potwierdzenia skuteczności i bezpieczeństwa leku.
- Tworzenie Artwork:
- Po zatwierdzeniu treści etykiety następnym krokiem jest stworzenie artwork etykiety. Obejmuje to zaprojektowanie elementów wizualnych, układu, czcionek i grafiki. artwork być zgodny z wytycznymi regulacyjnymi i dokładnie odzwierciedlać informacje zawarte na etykiecie.
- artwork etykiety artwork wewnętrznej weryfikacji w firmie farmaceutycznej w celu zapewnienia spójności i zgodności z przepisami. Zawiera ona takie informacje, jak instrukcje dotyczące dawkowania, ostrzeżenia, warunki przechowywania i dane kontaktowe.
- Ostateczna wersja artwork przedkładana organom regulacyjnym do zatwierdzenia. Ten etap gwarantuje, że wygląd etykiety jest zgodny z normami jakościowymi i skutecznie przekazuje użytkownikom istotne informacje.
- Produkcja i wdrażanie:
- Po zatwierdzeniu artwork etykiety artwork integralną częścią opakowania leku. Producenci dbają o to, aby etykiety były prawidłowo umieszczone na każdym opakowaniu produktu (np. butelkach, opakowaniach blistrowych, fiolkach).
- Procedury kontroli jakości weryfikują zgodność etykiet ze specyfikacjami, w tym dokładność treści, czytelność i zgodność z wytycznymi projektowymi.
- Etykieta służy jako pomost między firmą farmaceutyczną, agencjami regulacyjnymi, świadczeniodawcami opieki zdrowotnej i pacjentami. Odgrywa istotną rolę w zapewnieniu bezpiecznego i skutecznego stosowania leków przez cały cykl życia produktu.
Jakie są typowe wyzwania związane z etykietowaniem regulacyjnym?
Powszechne wyzwania związane z etykietowaniem regulacyjnym obejmują nadążanie za zmieniającymi się wymogami regulacyjnymi, zarządzanie etykietowaniem wielojęzycznym i zapewnianie spójności w różnych portfelach produktów. Dynamiczny charakter standardów regulacyjnych dotyczących etykietowania produktów farmaceutycznych wymaga ciągłej czujności, aby być na bieżąco z najnowszymi wymaganiami. Dostosowywanie się do zmieniających się przepisów i szybkie wdrażanie niezbędnych aktualizacji treści i formatu etykiet ma zasadnicze znaczenie dla zachowania zgodności i zapewnienia bezpieczeństwa pacjentów.
| Wyzwanie | Opis |
|---|---|
| Zmieniające się wymagania regulacyjne | Radzenie sobie z ciągle zmieniającymi się przepisami i wytycznymi, co wymaga ciągłych aktualizacji dokumentacji etykietowania. |
| Globalna harmonizacja | Zapewnienie spójności informacji o produkcie w różnych regionach, zgodnie ze zróżnicowanymi wymogami różnych organów ds. zdrowia. |
| Integracja danych po wprowadzeniu do obrotu | Zarządzanie włączaniem danych dotyczących bezpieczeństwa i skuteczności po wprowadzeniu do obrotu do oznakowania, z zachowaniem dokładności i adekwatności. |
| Zgodność z lokalnymi standardami etykietowania | Przestrzeganie określonych standardów etykietowania w poszczególnych krajach, z uwzględnieniem różnic językowych, kulturowych i formatowania. |
| Efektywne zarządzanie zmianą etykietowania | Usprawnienie procesów śledzenia, wdrażania i dokumentowania zmian etykiet szybko i dokładnie. |
Wielojęzyczne etykietowanie stanowi poważne wyzwanie dla firm farmaceutycznych działających na rynkach globalnych. Dokładne tłumaczenie treści etykiet na wiele języków przy jednoczesnym przestrzeganiu regionalnych niuansów językowych i regulacyjnych wymaga dbałości o szczegóły i solidnych procesów zarządzania tłumaczeniami. Zapewnienie spójności i jasności w różnych wersjach językowych ma kluczowe znaczenie dla skutecznego przekazywania istotnych informacji różnym populacjom pacjentów.
Utrzymanie spójności między portfelami produktów stanowi kolejne powszechne wyzwanie w zakresie etykietowania regulacyjnego. Firmy farmaceutyczne często zarządzają kilkoma produktami o różnych wymaganiach dotyczących etykietowania, formulacji i wskazań. Osiągnięcie spójności i zgodności w różnych liniach produktów przy jednoczesnym spełnieniu określonych wymagań regulacyjnych dla każdego produktu wymaga wydajnych procesów i systemów zapewniających jednolitość treści, formatu i przekazu etykiet.
Jakie są kluczowe przepisy regulujące etykietowanie produktów farmaceutycznych?
Etykiety farmaceutyczne podlegają złożonemu zestawowi przepisów mających na celu zapewnienie bezpieczeństwa, skuteczności i prawidłowego stosowania leków. Kilka z nich wymieniono poniżej:
US Agencja ds. Żywności i LekówFDA )
US FDA kwestię etykietowania produktów farmaceutycznych poprzez rygorystyczny zestaw przepisów określonych w Kodeksie Przepisów Federalnych (CFR) tytuł 21. Przepisy te wymagają, aby etykiety zawierały wyczerpujące informacje, w tym wskazania dotyczące stosowania leku, instrukcje stosowania, przeciwwskazania i potencjalne skutki uboczne. FDA znaczenie jasnego, precyzyjnego i jednoznacznego języka w celu zapewnienia bezpieczeństwa pacjentów i świadomego podejmowania decyzji przez pracowników służby zdrowia. Ponadto wymagania FDA dotyczące etykietowania obejmują różne aspekty, takie jak opakowania, ulotki i etykietowanie elektroniczne, zapewniając dostępność i standaryzację wszystkich informacji w różnych formatach. Zgodność z tymi przepisami jest obowiązkowa dla zatwierdzenia leku i dalszej obecności na rynku w Stanach Zjednoczonych.
EMA (Europejska Agencja Leków)
EMA nadzoruje etykietowanie produktów farmaceutycznych w Unii Europejskiej poprzez dyrektywy i wytyczne mające na celu harmonizację etykietowania w member states. Dyrektywa European Commission 2001/83/WE ma kluczowe znaczenie dla tych wysiłków, określając wymagania dotyczące Charakterystyki Produktu LeczniczegoSmPC), ulotek informacyjnych dla pacjentów i etykiet opakowań. EMA zapewnia, że etykiety zawierają istotne informacje zarówno dla pracowników służby zdrowia, jak i pacjentów, promując bezpieczne i skuteczne stosowanie leków w całej EU (European Union). Ponadto etykiety muszą być dostępne w językach urzędowych member states , w których lek jest sprzedawany, co odzwierciedla zaangażowanie EMA w dostępność i opiekę skoncentrowaną na pacjencie.
TGA (Therapeutic Goods Administration)
W Australii TGA jest odpowiedzialna za regulację etykietowania produktów farmaceutycznych na mocy ustawy Therapeutic Goods Act z 1989 roku. Wytyczne TGA nakazują, aby etykiety leków zawierały jasne, dokładne i wyczerpujące informacje o produkcie, w tym o jego składnikach, wskazaniach, dawkowaniu i potencjalnych zagrożeniach. Wymogi dotyczące etykietowania mają na celu ochronę zdrowia publicznego poprzez zapewnienie konsumentom i pracownikom służby zdrowia informacji niezbędnych do bezpiecznego i skutecznego stosowania leków. TGA kładzie również znaczący nacisk na czytelność etykiet, wymagając, aby były one napisane prostym językiem angielskim, a najważniejsze informacje były umieszczone w widocznym miejscu, aby zapobiec niewłaściwemu użyciu i błędom w stosowaniu leków.
Health Canada
Health Canada reguluje etykietowanie produktów farmaceutycznych w ramach, których priorytetem jest bezpieczeństwo i dobre samopoczucie pacjentów i pracowników służby zdrowia. Ustawa o żywności i lekach oraz powiązane z nią przepisy określają wymagania dotyczące etykiet leków, które muszą zawierać szczegółowe informacje na temat składu produktu, wskazań, przeciwwskazań i potencjalnych skutków ubocznych. Health Canada wymaga również, aby etykiety były dwujęzyczne, prezentowane zarówno w języku angielskim, jak i francuskim, aby uwzględnić różnorodność językową kraju. Ponadto Health Canada regularnie aktualizuje swoje wymagania dotyczące etykietowania, aby odzwierciedlić nowe dowody naukowe i zmieniające się potrzeby w zakresie zdrowia publicznego, zapewniając, że etykiety pozostają istotne i skuteczne w promowaniu bezpiecznego stosowania leków.
PMDA wyroby medyczne ds. Produktów Leczniczych i wyroby medyczne )
PMDA, japoński organ regulacyjny, nadzoruje etykietowanie produktów farmaceutycznych zgodnie z prawem farmaceutycznym i powiązanymi wytycznymi. PMDA wymaga, aby etykiety leków zawierały kompleksowe informacje, w tym wskazania, instrukcje dotyczące dawkowania i potencjalne działania niepożądane, w formacie zrozumiałym zarówno dla pracowników służby zdrowia, jak i pacjentów. PMDA wymaga również, aby etykiety zawierały ostrzeżenia i środki ostrożności specyficzne dla populacji japońskiej, biorąc pod uwagę takie czynniki, jak różnice genetyczne i praktyki kulturowe. Takie podejście zapewnia bezpieczne i skuteczne stosowanie leków w Japonii, z etykietami dostosowanymi do unikalnych potrzeb lokalnego rynku.
NMPA (Krajowa Administracja Produktów Medycznych)
W Chinach, NMPA reguluje etykietowanie farmaceutyków poprzez ramy regulacyjne, które kładą nacisk na dokładność, przejrzystość i bezpieczeństwo. Ustawa o administracji leków Chińskiej Republiki Ludowej określa wymagania dotyczące etykiet leków, które muszą zawierać informacje na temat wskazań, dawkowania, przeciwwskazań i potencjalnych skutków ubocznych leku. NMPA wymaga również, aby etykiety były prezentowane w uproszczonym języku chińskim, aby zapewnić dostępność dla miejscowej ludności. Dodatkowo, NMPA wymaga, aby etykiety były poddawane rygorystycznemu przeglądowi podczas procesu zatwierdzania leków w celu zapewnienia zgodności z normami krajowymi i ochrony zdrowia publicznego poprzez zapobieganie błędom w stosowaniu leków i ich niewłaściwemu stosowaniu.
W jaki sposób partner regulacyjny może pomóc w osiągnięciu zgodności z wymogami dotyczącymi etykietowania?
Partner regulacyjny odgrywa kluczową rolę w zapewnieniu zgodności z wymogami dotyczącymi etykietowania, oferując specjalistyczną wiedzę i kompleksowe wsparcie. Pomaga firmom poruszać się po skomplikowanym świecie przepisów, dbając o to, żeby materiały związane z etykietowaniem – w tym opakowania, ulotki i etykiety elektroniczne – były zgodne z konkretnymi wymogami różnych organów ds. zdrowia, takich jak US FDA, EMA, TGA, Health Canada, PMDA i NMPA. Wymaga to zrozumienia i stosowania najnowszych przepisów, które mogą się znacznie różnić w zależności od regionu, żeby mieć pewność, że wszystkie informacje o produkcie są dokładne, kompletne i zgodne z przepisami.
Co więcej, partner regulacyjny pomaga usprawnić proces etykietowania, zapewniając krytyczne usługi, takie jak tworzenie, przegląd i walidacja treści. Pomagają oni w opracowywaniu i korygowaniu treści etykiet w celu dostosowania ich do standardów regulacyjnych i zapewnienia, że wszystkie niezbędne informacje są zawarte, od wykazów składników i instrukcji użytkowania po ostrzeżenia dotyczące bezpieczeństwa i warunki przechowywania. Zmniejsza to ryzyko błędów i pominięć, które mogłyby prowadzić do opóźnień regulacyjnych lub wycofania z rynku, przyspieszając czas wprowadzania nowych produktów na rynek.

Ponadto, partner ds. regulacji wspiera firmy w utrzymywaniu ciągłej zgodności poprzez monitorowanie aktualizacji przepisów i wdrażanie zmian w razie potrzeby. Oferują strategiczne doradztwo w zakresie dostosowywania etykiet do nowych wytycznych lub pojawiających się wymagań rynkowych, pomagając firmom uniknąć niezgodności i zapewniając, że ich produkty pozostają zgodne z obowiązującymi przepisami. Wykorzystując swoją wiedzę specjalistyczną i będąc na bieżąco ze zmianami regulacyjnymi, partner regulacyjny pomaga firmom sprawnie i skutecznie poruszać się w dynamicznym środowisku etykietowania.
Jak firmy mogą rozpocząć korzystanie z Regulatory Labeling Services?
Aby rozpocząć korzystanie z Regulatory labeling servicesowania regulacyjnego, firmy powinny najpierw ocenić swoje konkretne potrzeby w zakresie etykietowania w oparciu o rynki docelowe i wymogi regulacyjne. Następnie powinny nawiązać współpracę z wiarygodnym dostawcą usług w zakresie etykietowania, posiadającym doświadczenie w zakresie globalnych standardów etykietowania. Dostawca ten może pomóc w opracowaniu, przeglądzie i aktualizacji etykiet w celu zapewnienia zgodności. Ponadto wdrożenie scentralizowanego systemu zarządzania etykietami pomaga usprawnić proces, zapewniając spójność wszystkich etykiet produktów. Regularne audyty i aktualizacje są niezbędne, aby etykiety były zgodne ze zmieniającymi się przepisami.
Ocena potrzeb regulacyjnych:
- Określenie konkretnych wymogów prawnych mających zastosowanie do produktu i rynków docelowych.
- Zrozumienie kluczowych dokumentów, takich jak podstawowe arkusze danychCDS), broszury badawczeIB) i lokalne wymagania dotyczące etykietowania.
Wybierz partnera ds. etykietowania regulacyjnego:
- Zbadaj i wybierz renomowanego dostawcę usług etykietowania regulacyjnego z doświadczeniem w swojej branży.
- Weź pod uwagę takie czynniki, jak doświadczenie, globalna wiedza regulacyjna i zdolność do radzenia sobie z różnymi wyzwaniami związanymi z etykietowaniem.
Określenie zakresu projektu:
- Jasno określ zakres projektu etykietowania regulacyjnego, w tym rodzaj wymaganych usług (np. opracowanie IB , utworzenie CCDS , przegląd zgodności etykietowania).
- Ustalenie harmonogramów, kamieni milowych i rezultatów dla każdej fazy projektu.
Współpraca przy gromadzeniu danych:
- Ściśle współpracuj z wybranym partnerem ds. etykietowania regulacyjnego, aby zebrać niezbędne dane, w tym informacje dotyczące badań klinicznych, dane dotyczące bezpieczeństwa i skuteczności oraz wszelkie Nadzór po wprowadzeniu do obrotu .
Inicjowanie tworzenia i przeglądania dokumentów:
- Rozpoczęcie tworzenia lub rewizji kluczowych dokumentów, takich jak IB, DCDS, CCDS i lokalnych treści etykiet.
- Ułatwianie regularnych przeglądów i sesji informacji zwrotnych w celu zapewnienia dokładności i zgodności z wymogami regulacyjnymi.
Wdrożenie procesów kontroli zmian:
- Opracowanie solidnych procesów kontroli zmian w celu etykietowania aktualizacji i szybkiego śledzenia wszelkich modyfikacji podstawowych dokumentów.
- Zapewnienie, że zmiany są wdrażane konsekwentnie w globalnych i regionalnych etykietach.
Monitorowanie zgodności:
- Ustanowienie mechanizmów bieżącego monitorowania zgodności ze zmieniającymi się standardami regulacyjnymi.
- Bądź na bieżąco ze zmianami w przepisach i odpowiednio aktualizuj dokumenty dotyczące etykietowania.
Wykorzystanie technologii i automatyzacji:
- Wykorzystaj oprogramowanie i technologię do etykietowania w celu zwiększenia dokładności, wydajności i zarządzania dokumentami.
- Poznaj narzędzia wspierające sztuczną inteligencję w celu usprawnienia procesów wdrażania i weryfikacji arkuszy danych.
Zaangażowanie ekspertów ds. regulacji:
- Zaangażuj ekspertów ds. regulacji lub konsultantów w ramach swojej organizacji lub za pośrednictwem wybranego usługodawcy, aby zapewnić wgląd i wskazówki w całym procesie etykietowania.
Ciągłe doskonalenie:
- Ustanowienie kultury ciągłego doskonalenia, regularne przeglądanie i udoskonalanie procesów etykietowania w oparciu o informacje zwrotne, zmiany w branży i ewoluujące krajobrazy regulacyjne.
Czy Regulatory Labeling Services mogą pomóc w monitorowaniu po wprowadzeniu do obrotu?
Tak, Regulatory labeling services mogą rzeczywiście pomóc w monitorowaniu produktów farmaceutycznych po ich wprowadzeniu na rynek. Usługi te odgrywają kluczową rolę we wspieraniu nadzoru po wprowadzeniu na rynek poprzez ułatwianie zarządzania aktualizacjami etykiet, obsługę zmian etykiet związanych z bezpieczeństwem i zapewnianie zgodności z wymogami regulacyjnymi po zatwierdzeniu. Utrzymując dokładne i aktualne informacje na etykietach, Regulatory labeling services pomagają firmom farmaceutycznym reagować na obawy dotyczące bezpieczeństwa i terminowo wdrażać niezbędne zmiany w celu zapewnienia ciągłej zgodności z przepisami i bezpieczeństwa pacjentów.
Ponadto Regulatory labeling services pomóc w skutecznym rozpowszechnianiu aktualnych informacji dotyczących bezpieczeństwa wśród pracowników służby zdrowia i pacjentów. W przypadku pojawienia się nowych ustaleń dotyczących bezpieczeństwa lub zmian w profilach ryzyka produktów farmaceutycznych eksperci ds. etykietowania regulacyjnego mogą pomóc w szybkiej aktualizacji treści etykiet, aby odzwierciedlały one najnowsze dane dotyczące bezpieczeństwa i wymogi regulacyjne. Takie proaktywne podejście do monitorowania po wprowadzeniu produktu do obrotu i aktualizacji etykiet wspiera terminowe przekazywanie ważnych informacji dotyczących bezpieczeństwa pracownikom służby zdrowia i pacjentom, przyczyniając się do poprawy monitorowanie bezpieczeństwa stosowania produktów leczniczych nigdy nie tłumacz jako system fotowoltaiczny opieki nad pacjentami.
Ogólnie rzecz biorąc, Regulatory labeling services w zakresie Regulatory labeling services regulacyjnego zapewniają cenne wsparcie w monitorowaniu po wprowadzeniu na rynek, zapewniając, że produkty farmaceutyczne zachowują dokładne i zgodne z przepisami etykietowanie przez cały cykl życia. Wykorzystując wiedzę specjalistów ds. regulacji i efektywne procesy zarządzania etykietowaniem, firmy mogą skutecznie zająć się kwestiami bezpieczeństwa po wprowadzeniu produktu na rynek i obowiązkami regulacyjnymi, przyczyniając się tym samym do ciągłego bezpieczeństwa i skuteczności swoich produktów na rynku.
Dlaczego warto wybrać Freyr?
Dekada doskonałości w zakresie etykietowania regulacyjnego
Ponad 180 globalnych ekspertów w dziedzinie usług etykietowania
Specjalizuje się w tworzeniu i zarządzaniu niezbędnymi dokumentami
Wiedza specjalistyczna w zakresie broszur badawczych, podstawowych arkuszy danych i podstawowych arkuszy danych firmy
Zaangażowanie w globalną zgodność i precyzję
Wykorzystuje AI (Artificial Intelligence) do wydajnej nawigacji regulacyjnej
Szybkie fakty
+
+
+
Nasze usługi
Często zadawane pytania
Podstawowe arkusze danychCDS) zapewniają skonsolidowane podsumowanie najważniejszych informacji o lekach, w tym wskazań, dawek i profili bezpieczeństwa. Zapewniają one spójną komunikację istotnych szczegółów na rynkach globalnych, ułatwiając zachowanie zgodności z przepisami i podejmowanie świadomych decyzji. CDS służą również jako punkt odniesienia przy tworzeniu lokalnych etykiet produktów.
Broszury badawcze (IB) zawierają szczegółowe dane dotyczące badań klinicznych i informacje na temat rozwoju leków do celów badawczych, natomiast arkusze danych podstawowych firmy (CCDS) zawierają podsumowanie kluczowych danych dotyczących bezpieczeństwa i skuteczności do celów regulacyjnych na całym świecie, stanowiąc wytyczne dotyczące treści etykiet i aktualizacji. CCDS wykorzystywane do tworzenia etykiet produktów przeznaczonych do dopuszczenia do obrotu.
Sztuczna inteligencja usprawnia etykietowanie regulacyjne poprzez automatyzację analizy danych, poprawę dokładności tworzenia treści i przyspieszenie przeglądów dokumentów. Narzędzia sztucznej inteligencji usprawniają procesy etykietowania i zapewniają spójność różnych wymogów regulacyjnych. Pomagają również w przewidywaniu i rozwiązywaniu potencjalnych kwestii zgodności.
Wielojęzyczne etykiety zapewniają, że produkty farmaceutyczne są dostępne dla różnych populacji pacjentów, spełniając regionalne wymogi prawne i zwiększając bezpieczeństwo poprzez dostarczanie jasnych, zrozumiałych instrukcji i ostrzeżeń w wielu językach. Zmniejsza to ryzyko błędnej komunikacji i błędów w podawaniu leków.
Scentralizowany system zarządzania etykietami koordynuje tworzenie, przegląd i aktualizację dokumentów etykiet, zapewniając spójność i zgodność na rynkach globalnych. Usprawnia procesy i utrzymuje dokładne, aktualne informacje o produkcie. System ten wspiera również wydajną obsługę zmian etykiet i aktualizacji przepisów.
Structured Product Labeling (SPL) to XML format używany do etykietowania leków, który standaryzuje i organizuje informacje o produkcie. Zapewnia spójność i ułatwia wymianę danych między agencjami regulacyjnymi i producentami. SPL wspiera efektywne zarządzanie informacjami na etykietach przez cały cykl życia produktu.
Globalny Numer Lokalizacyjny (GLN) to unikalny identyfikator używany do identyfikacji lokalizacji i podmiotów w łańcuchu dostaw. Pomaga on w dokładnym śledzeniu i zarządzaniu produktami farmaceutycznymi na rynkach globalnych. Numery GLN zapewniają precyzyjną i wydajną dystrybucję produktów oraz zarządzanie zapasami.
National Drug Code (NDC) to unikalny identyfikator leków nadawany przez FDA. Pomaga on w precyzyjnej identyfikacji produktów leczniczych oraz ułatwia zarządzanie i śledzenie zapasów. NDC ma kluczowe znaczenie dla dokładnego wydawania leków i sprawozdawczości regulacyjnej.
Broszura badaczaIB) zawiera szczegółowe informacje na temat danych klinicznych i przedklinicznych badanego leku. Jest ona wykorzystywana do informowania badaczy klinicznych o bezpieczeństwie, skuteczności i dawkowaniu leku do celów badania. IB wspiera również etyczne i świadome podejmowanie decyzji w badaniach klinicznych.












