BIMO to skrót od Bioresearch Monitoring, czyli program kontroli na miejscu i audytów danych, który ma na celu monitorowanie wszystkich aspektów prowadzenia i raportowania badań regulowanych przez US Agencję US i Leków (FDA). Program został ustanowiony w 1977 r. po stwierdzeniu potrzeby kontroli ośrodków badań klinicznych. Głównym celem tego programu jest zapewnienie jakości i integralności danych przedkładanych w celu zatwierdzenia nowych produktów i wniosków marketingowych. Ponadto program ten chroni również prawa i dobrostan ludzi oraz zwierząt biorących udział w badaniach FDA.
Główne cele programu BIMO
Rocznie przeprowadzanych jest ponad 1000 kontroli. Główne cele objęte programem BIMO to:
- Audyt danych klinicznych
- Kontrola trwających badań klinicznych
- Kontrola laboratoriów nieklinicznych
- Kontrola instytucjonalnych komisji rewizyjnych (IRB)
Które produkty podlegają audytowi BIMO?
Program BIMO ma zastosowanie do leków, produktów biologicznych, wyroby medyczne, produktów spożywczych, wyrobów tytoniowych i produktów weterynaryjnych. Program zgodności jest nadzorowany przez sześć (06) centrów produktowych FDA– Centrum Oceny i Badań Produktów Biologicznych (CBER), Centrum Urządzeń i Zdrowia Radiologicznego (CDRH), Centrum Oceny i Badań Leków (CDER), Centrum Bezpieczeństwa Żywności i Żywienia Stosowanego (CFSAN), Centrum Wyrobów Tytoniowych (CTP) oraz Centrum Medycyny Weterynaryjnej (CVM).
Które firmy podlegają audytowi BIMO?
Zarówno krajowe, jak i międzynarodowe firmy prowadzące lub podlegające któremukolwiek z poniższych działań podlegają wymogom Bioresearch Monitoring.
- Niekliniczne laboratoria badawcze zapewniające zgodność z Dobrą Praktyką LaboratoryjnąGLP)
- Badacze kliniczni zapewniający zgodność z zasadami Dobrej Praktyki Klinicznej (GCP)
- Sponsorzy
- Organizacje badawcze działające na zlecenie (CRO)
- Monitory badań klinicznych
- Urządzenia do równoważności biologicznej in vivo
- Instytucjonalne komisje rewizyjne (IRB)
Które programy zgodności są objęte programem BIMO?
US FDA w dowolnym momencie przeprowadzić audyt BIMO w ramach siedmiu (07) wieloośrodkowych programów zgodności. Te siedem wieloośrodkowych programów zgodności jest realizowanych poprzez:
- Inspekcja badacza klinicznego (CI) i badacza-sponsora (SI)
- Kontrola przez Instytucjonalną Komisję Rewizyjną (IRB)
- Inspekcja organizacji badawczej na zlecenie/sponsora/monitoraCRO)
- Inspekcja Dobrej Praktyki LaboratoryjnejGLP)
- Kontrola biorównoważności i biodostępności (BEQ)
- Inspekcja raportowania działań niepożądanych po wprowadzeniu leku do obrotu (PADE)
- Ocena ryzyka, łagodzenie skutków i strategia (REMS) Inspekcja sprawozdawczości
Każdy z tych programów określa szczegółowy zakres przeglądu lub inspekcji, które należy przeprowadzić w celu zapewnienia zgodności z FDA.
Jakie przepisy mają zastosowanie do audytu BIMO?
Przepisy - 21 CFR 50 - Ochrona osób, których dotyczy badanie, 21 CFR 54 - Ujawnianie informacji finansowych, 21 CFR 56 - Rady ds. kontroli wewnętrznej, 21 CFR 58 - Dobra praktyka laboratoryjna dla laboratoriów nieklinicznych, 21 CFR 809 - Produkty do diagnostyki in vitro oraz 21 CFR 812 - Zwolnienie z obowiązku stosowania urządzeń badawczych mają zastosowanie do audytu BIMO.
Ile audytów jest przeprowadzanych rocznie w ramach programu BIMO?
Liczba audytów BIMO przeprowadzanych przez US agencjęFDA z roku na rok. W ostatnich latach liczba kontroli na miejscu spadła z powodu pandemii COVID-19, a FDA wstrzymać wszystkie kontrole na miejscu dotyczące badań klinicznych. Monitorowano tylko określone, krytyczne i kluczowe badania kliniczne.
"Zdalne oceny regulacyjne" (RRA) zostały wprowadzone podczas pandemii COVID-19 w celu zdalnego monitorowania badań regulowanych. Oceny RRA są przeprowadzane za pośrednictwem telekonferencji wideo i są dobrowolną inicjatywą zdalnej oceny danych i procesów. Należy jednak zauważyć, że oceny RRA nie są równoważne ani alternatywne dla kontroli na miejscu, ale są jedynie procedurą, która ewoluowała w związku z pandemią COVID-19.
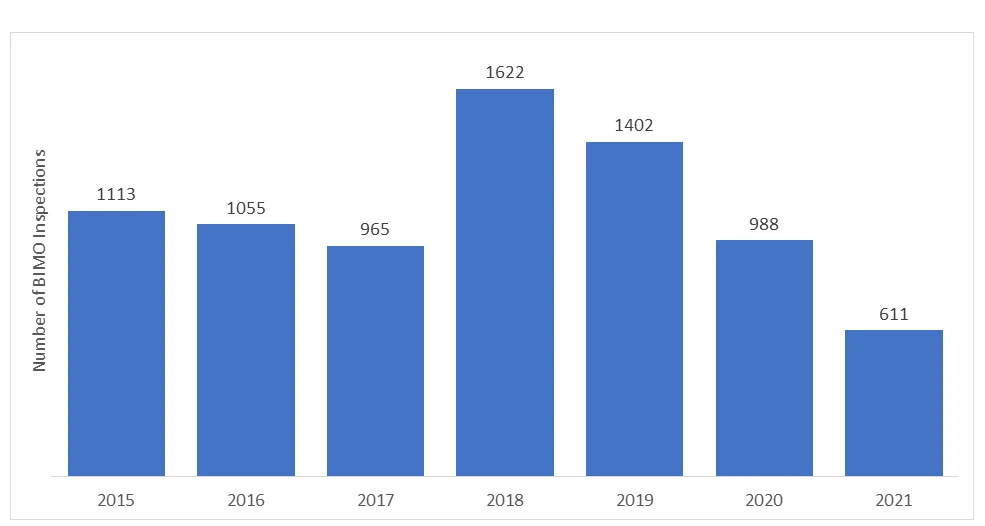
*Dane za lata 2020 i 2021 nie obejmują inspekcji RRA.
Ile zdalnych ocen regulacyjnych (RRA) przeprowadzono podczas pandemii COVID-19 w ramach programu BIMO?
W 2021 r. liczba inspekcji RRA znacznie wzrosła we wszystkich programach. W kwietniu 2021 r. FDA opublikowała wytyczne "Remote Interactive Evaluations of Drug Manufacturing and Bioresearch Monitoring Facilities During the COVID-19 Public Health Emergency Guidance for Industry", które zawierają wyczerpujące informacje na temat procesu przeprowadzania RRA przez FDA.
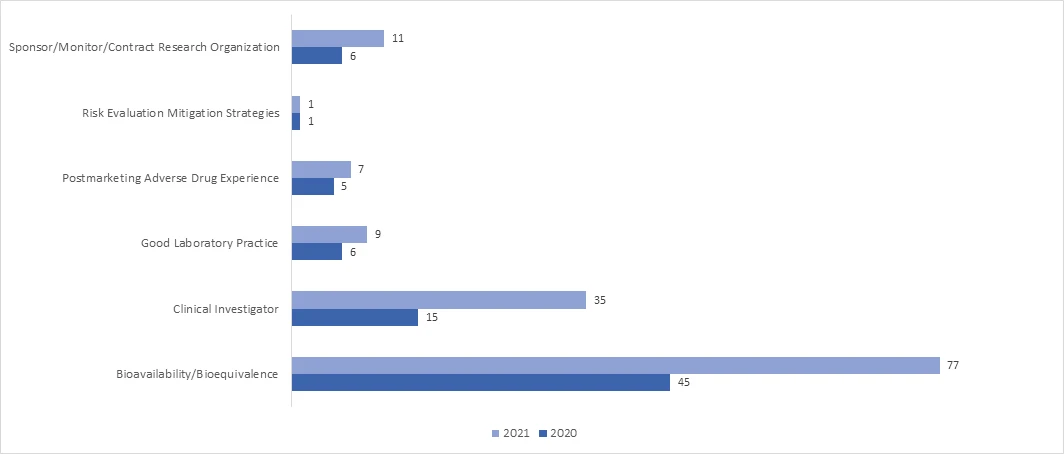
Jakie są możliwe wyniki audytu BIMO?
Podczas audytu BIMO US agencjaFDA podjąć dowolne z poniższych działań w oparciu o zgodność z przepisami:
1. Brak wskazanych działań (NAI)
NAI ma zastosowanie, gdy inspektor terenowy FDA nie zidentyfikował żadnych budzących zastrzeżenia praktyk lub tylko drobne kwestie, w przypadku których dalsze działania nie są uzasadnione.
2. Wskazane działanie dobrowolne (VAI)
VAI ma zastosowanie, gdy zidentyfikowano budzące zastrzeżenia praktyki, ale nie są one znaczące.
3. Wskazane działanie urzędowe (OAI)
OAI ma zastosowanie w przypadku zidentyfikowania budzących zastrzeżenia praktyk, które zagrażają integralności danych i/lub prawom osób, których dane dotyczą.
Jakie są najczęstsze niezgodności wydawane w ramach audytu BIMO?
Niektóre z najczęstszych niezgodności zaobserwowanych podczas audytu BIMO to
- Nieprawidłowe prowadzenie rejestrów
- Niepowodzenie w odniesieniu do planu badawczego
- Nieprzestrzeganie przepisów
- Niepowodzenie w monitorowaniu protokołów
- Nieodpowiednia ochrona podmiotów
- Nieodpowiednia odpowiedzialność za badany produkt
Audyt BIMO ma kluczowe znaczenie dla każdego producenta lub twórcy nowych wyroby medyczne technologii, który planuje wprowadzić swoje urządzenie na US . Bardzo ważne jest przestrzeganie przepisów i wytycznych, aby uniknąć opisanych pułapek.
Potrzebujesz pomocy w zakresie kontroli audytowych BIMO? Reach się z Freyr. Bądź na bieżąco. Bądź zgodny z przepisami.