Ninsho (certyfikacja wyrobów medycznych) to japoński system certyfikacji zewnętrznej, w ramach którego zarejestrowana jednostka certyfikująca (RCB), akredytowana przez Ministerstwo Zdrowia, Pracy i Opieki Społecznej (MHLW), certyfikuje wyroby medyczne podlegające ścisłej kontroli. System ten ma zastosowanie do wyrobów klasy II oraz ograniczonej liczby wyrobów klasy III, które posiadają odpowiednią normę japońską (JIS). Kilka wyroby medyczne klasy II, wyroby medyczne nie ustalono kryteriów certyfikacji, wymaga zatwierdzenia w ramach programu Shonin.
Jakie są inne ścieżki rejestracji urządzeń w Japonii?
W Japonii ścieżki Todokede i Shonin są również wykorzystywane do zatwierdzania urządzeń medycznych oprócz Ninsho. W zależności od kategorii ryzyka urządzenia i dostępności predykatów w Japonii, producent musi starannie zaplanować zgłoszenie urządzenia.
Jakie są wymagania wstępne dla certyfikatu Ninsho?
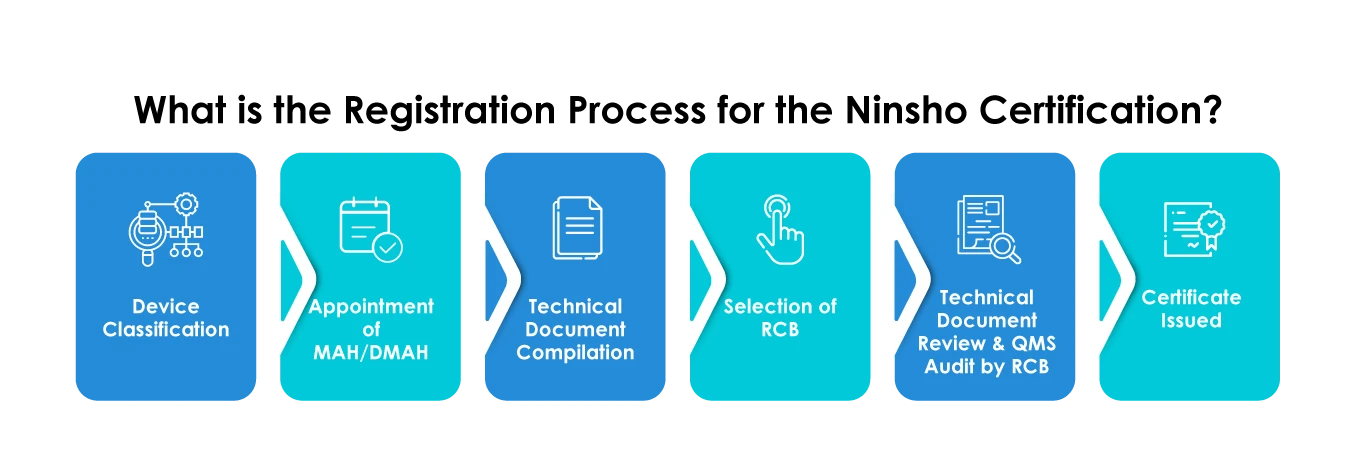
Producenci rejestrujący swoje urządzenia za pośrednictwem ścieżki Ninsho muszą skrupulatnie planować zgłoszenia pod kątem następujących kwestii:
- Wybór RCB
- Przekazanie ogólnych danych urządzenia, takich jak kategoria urządzenia medycznego, zamierzone zastosowanie, dane analizy ryzyka skuteczności, dane kliniczne itp.
- Dostarczanie streszczenia dokumentacji technicznej (STED)
- Dokumenty powinny być dostarczane wyłącznie w języku japońskim
- Zagraniczni producenci muszą obowiązkowo wyznaczyć Pozwolenie na dopuszczenie do obrotu produktu leczniczego (MAH) lub wyznaczonego Pozwolenie na dopuszczenie do obrotu produktu leczniczego (DMAH).
- Zagraniczni producenci muszą zarejestrować się w MHLW uzyskać certyfikat rejestracji zagranicznego producenta (FMR) dla swoich zakładów produkcyjnych.
Czym są RCB?
Zarejestrowane jednostki certyfikujące (RCB) to niezależne jednostki certyfikujące akredytowane przez MHLW. RCB są odpowiedzialne za ocenę i certyfikację wyroby medyczne do ścieżki Ninsho i objętych tą ścieżką. RCB są również odpowiedzialne za przeprowadzanie audytu systemu zarządzania jakością w zakładzie producenta.
Jakie są wymagania SZJ dotyczące rejestracji urządzeń w ramach ścieżki Ninsho?
Producenci muszą spełniać wszystkie wymagania QMS określone w Rozporządzeniu 169. MAH lub DMAH musi złożyć wniosek do RCB. RCB przeprowadzi szczegółową inspekcję SZJ w zakładzie producenta i, po zadowalającym wdrożeniu SZJ, wyda certyfikat.
Jaki jest średni czas wymagany do uzyskania certyfikatu Ninsho?
RCB zazwyczaj potrzebuje od trzech (03) do pięciu (05) miesięcy na ukończenie oceny technicznej, przeprowadzenie audytu QMS i wydanie certyfikatu Ninsho.
Czy istnieje harmonogram wygaśnięcia certyfikatu Ninsho?
Rejestracja urządzenia medycznego nie wygasa, ale sponsor powinien odnawiać certyfikaty QMS co pięć (05) lat.
Japonia, będąca trzecim co do wielkości rynkiem wyroby medyczne Stanach Zjednoczonych i Chinach, oferuje ogromne możliwości producentom urządzeń medycznych z całego świata. Producenci chcący wprowadzić swoje urządzenia na rynek japoński muszą dokładnie zaplanować proces certyfikacji i zatwierdzania wyrobów medycznych, ponieważ PMDA określone wymagania regulacyjne. Producenci mogą zdecydować się na współpracę z niezawodnym partnerem regulacyjnym, aby uzyskać bezproblemowy dostęp do rynku japońskiego.
Aby dowiedzieć się więcej na temat certyfikacji wyrobów medycznych w Japonii lub innych przepisów PMDA , skontaktuj się z Freyr już dziś!