Innowacyjne wyroby medyczne zasadnicze wyroby medyczne dla poprawy wyników opieki zdrowotnej, zaspokajania zmieniających się potrzeb medycznych oraz zapewniania opłacalnych rozwiązań dla pacjentów i podmiotów świadczących usługi medyczne.StrategiaSAKIGAKEto przyspieszony proces oceny i zatwierdzania innowacyjnych wyroby medyczne Japonii. Strategia ta została zainicjowana przez japońskie Ministerstwo Zdrowia, Pracy i Opieki Społecznej (MHLW) w 2015 r. w celu przyspieszenia rozwoju i komercjalizacji innowacyjnych wyroby medyczne Japonii.
W ramach strategii SAKIGAKE wyroby medyczne określone kryteria innowacyjności mogą zostać poddane priorytetowej ocenie i zatwierdzeniu przez wyroby medyczne Produktów Leczniczych i wyroby medyczne (PMDA), organ regulacyjny odpowiedzialny za zatwierdzanie wyrobów medycznych w Japonii. Kryteria innowacyjności obejmują:
- Urządzenia o wysokiej skuteczności; oczekuje się, że urządzenie zapewni znaczące korzyści kliniczne dzięki nowatorskiemu mechanizmowi działania i radykalnej poprawie stanu pacjentów w porównaniu z istniejącymi wyroby medyczne.
- Po pierwsze, urządzenie może być zatwierdzone w Japonii lub jednocześnie w Japonii i innych krajach.
- Urządzenie może zaspokoić niezaspokojone potrzeby medyczne w Japonii. Docelowa choroba powinna być poważna, zagrażająca życiu lub z uporczywymi objawami.
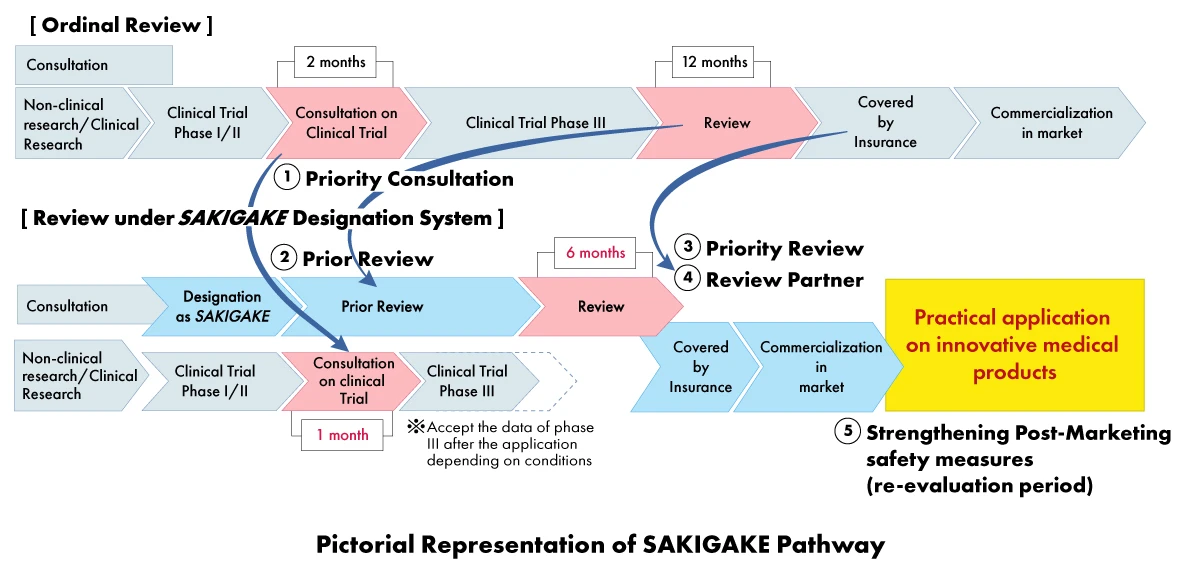
W ramach strategii SAKIGAKE producenci urządzeń medycznych mogą uzyskać szereg korzyści, w tym
- Konsultacje priorytetowe: Skrócenie czasu oczekiwania na konsultację badania klinicznego do jednego (01) miesiąca.
- Przegląd priorytetowy: Produkty wyznaczone przez SAKIGAKE otrzymują priorytetowy przegląd, którego celem jest zakończenie procesu przeglądu w ciągu sześciu (06) miesięcy zamiast 12 miesięcy.
- Skuteczna weryfikacja przed złożeniem wniosku: Zachęcanie do konsultacji i przyjmowanie materiałów w języku angielskim.
- Dedykowany partner ds. weryfikacji: Każdemu produktowi wyznaczonemu przez SAKIGAKE przypisany jest dedykowany menedżer ds. weryfikacji dla całego procesu zatwierdzania.
- Wzmocnienie środków bezpieczeństwa po wprowadzeniu do obrotu: Wydłużenie okresu ponownego badania i ułatwienie kontaktów z towarzystwami naukowymi.
Jak złożyć wniosek?
- Przez Wnioskodawcę: Wnioskodawca składa wniosek do Działu Oceny i Licencjonowania PMDA (ELD).
- PMDA: ELD zbliża się do potencjalnego wnioskodawcy.
P.C- PMDA, Japonia.
Ogólnie rzecz biorąc, system SAKIGAKE zapewnia przyspieszoną ścieżkę rozwoju i zatwierdzania innowacyjnych wyroby medyczne Japonii. Jego celem jest poprawa wyników leczenia pacjentów i promowanie innowacji w branży wyrobów medycznych. Producent musi skonsultować się z PMDA procesu rozwoju, aby omówić wymagania regulacyjne i uzyskać informacje zwrotne na temat planów rozwoju produktu.
Aby dowiedzieć się więcej o ścieżkach rejestracji urządzeń medycznych w Japonii, reach się z ekspertem ds. regulacji prawnych już teraz! Bądź na bieżąco. Zachowaj zgodność z przepisami.