Shonin (zatwierdzenie przed wprowadzeniem do obrotu) to ścieżka regulacyjna służąca do rejestracji wyroby medyczne Japonii. Ścieżka Shonin służy przede wszystkim do rejestracji wyroby medyczne klasy II i III wyroby medyczne których nie są dostępne standardy klasyfikacji PMDA. W przypadku wyrobów wysokiego ryzyka klasy IV producenci również powinni złożyć wniosek Shonin. PMDA odpowiedzialna za rozpatrzenie i zatwierdzenie wniosku Shonin.
Jakie są inne ścieżki rejestracji urządzeń w Japonii?
Oprócz Shonin, ścieżki Todokede i Ninsho są również wykorzystywane do zatwierdzania urządzeń medycznych w Japonii. Producenci urządzeń medycznych mogą wybrać jedną z nich w zależności od klasy ryzyka urządzenia i dostępności predykatów w Japonii. Producent powinien zidentyfikować klasyfikację urządzenia i sprawdzić dostępność japońskiej normy przemysłowej (JIS) przed określeniem odpowiedniej ścieżki rejestracji.
- Todokede (zgłoszenie przed wprowadzeniem do obrotu) - ma zastosowanie do urządzeń klasy I i wymaga od producentów przedłożenia PMDA zgłoszenia przed wprowadzeniem do obrotu w celu zatwierdzenia.
- Ninsho (Certyfikacja przed wprowadzeniem na rynek) - ma zastosowanie do urządzeń generycznych klasy II i III posiadających normy certyfikacji (normy JIS). Zarejestrowana jednostka certyfikująca (RCB) jest odpowiedzialna za przegląd i zatwierdzenie wniosku.
Jakie są wymagania wstępne dla rejestracji Shonin?
Producenci rejestrujący swoje urządzenia za pośrednictwem ścieżki Shonin muszą skrupulatnie planować zgłoszenia. Muszą zapewnić następujące elementy:
- Przesłanie ogólnych danych urządzenia, takich jak kategoria urządzenia medycznego, zamierzone zastosowanie, dane analizy ryzyka skuteczności, dane kliniczne itp.
- Dostarczanie streszczenia dokumentacji technicznej (STED)
- Dostarczanie dokumentów wyłącznie w języku japońskim
- Zagraniczni producenci mają obowiązek wyznaczyć Pozwolenie na dopuszczenie do obrotu produktu leczniczego (MAH) lub wyznaczonego Pozwolenie na dopuszczenie do obrotu produktu leczniczego (DMAH).
- Zagraniczni producenci muszą uzyskać certyfikat Foreign Manufacturer Registration (FMR) dla swoich zakładów produkcyjnych.
Jakie są wymagania SZJ dotyczące rejestracji urządzeń w ramach ścieżki Shonin?
Producenci muszą spełniać wszystkie wymagania QMS określone w Rozporządzeniu 169. Sponsor, DMAH lub MAH musi złożyć wniosek do PMDA. PMDA przeprowadza szczegółową inspekcję SZJ w zakładzie producenta i wydaje certyfikat po zadowalającym wdrożeniu SZJ.
Jak wygląda proces rejestracji w celu zatwierdzenia urządzenia w ramach ścieżki Shonin?
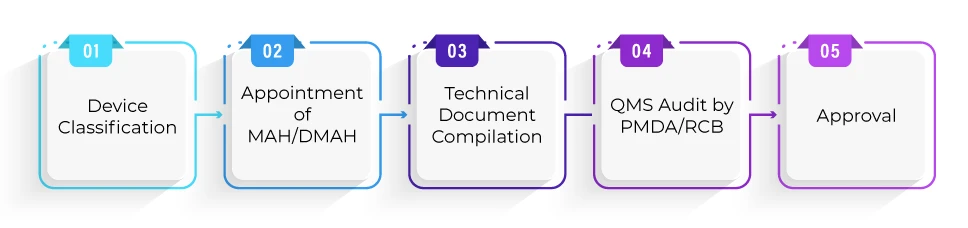
Jaki jest średni czas wymagany do zatwierdzenia urządzenia w ramach ścieżki Shonin?
PMDA zwykle wymaga 12 miesięcy na ocenę techniczną od daty otrzymania wniosku Shonin. Producent musi uwzględnić czas potrzebny na przygotowanie dokumentów zgłoszeniowych lub przeprowadzenie badań klinicznych w swoich harmonogramach projektu.
Czy istnieje harmonogram wygaśnięcia rejestracji urządzenia w ramach ścieżki Shonin?
Rejestracja urządzenia medycznego nie wygasa, ale sponsor powinien odnawiać certyfikaty QMS co pięć (05) lat.
Japonia jest lukratywnym rynkiem, ale nieodłącznie wiąże się z zawiłościami regulacyjnymi i barierami językowymi. Producenci muszą wziąć pod uwagę te czynniki i aktywnie zaplanować strategię wejścia na rynek (GTM) w Japonii. Producenci wyrobów medycznych i IVD mogą zdecydować się na outsourcing wszystkich niuansów regulacyjnych do wiarygodnego partnera regulacyjnego i wykorzystać zasoby, aby skupić się na innych istotnych elementach.
Aby dowiedzieć się więcej na temat zatwierdzania urządzeń medycznych Shonin w Japonii lub innych przepisów PMDA Japan, skontaktuj się z ekspertami Freyrds . regulacji prawnychjuż dziś.