
Le saviez-vous ? On peut économiser jusqu'à un million dans les trois (03) années à venir en introduisant la Computer Software Assurance (CSA) à la place de l'actuel modèle de validation des systèmes informatiques (CSV) !
Au fil des ans, les organisations pharmaceutiques ont intégré le CSV, une approche de validation basée sur le risque, pour s'assurer que les systèmes d'exploitation informatiques sont conformes aux exigences réglementaires.
Alors que le secteur se prépare actuellement à la prochaine transformation (après l'approche fondée sur les risques), à savoir l'évaluation de la sécurité des logiciels (CSA), USFDA de publier en 2022 de nouvelles lignes directrices sur la CSA afin d'aider les organisations à comprendre la qualité des produits et la conformité réglementaire. Ces lignes directrices devraient permettre de mieux comprendre comment, où et quelles mesures doivent être prises pour mener à bien une évaluation des risques logiciels.
Examinons maintenant de manière générale la comparaison entre CSV et CSA du point de vue des processus, des personnes et de la technologie, et la manière dont une mise en œuvre réussie de CSA peut apporter des avantages tangibles à une organisation.
Processus
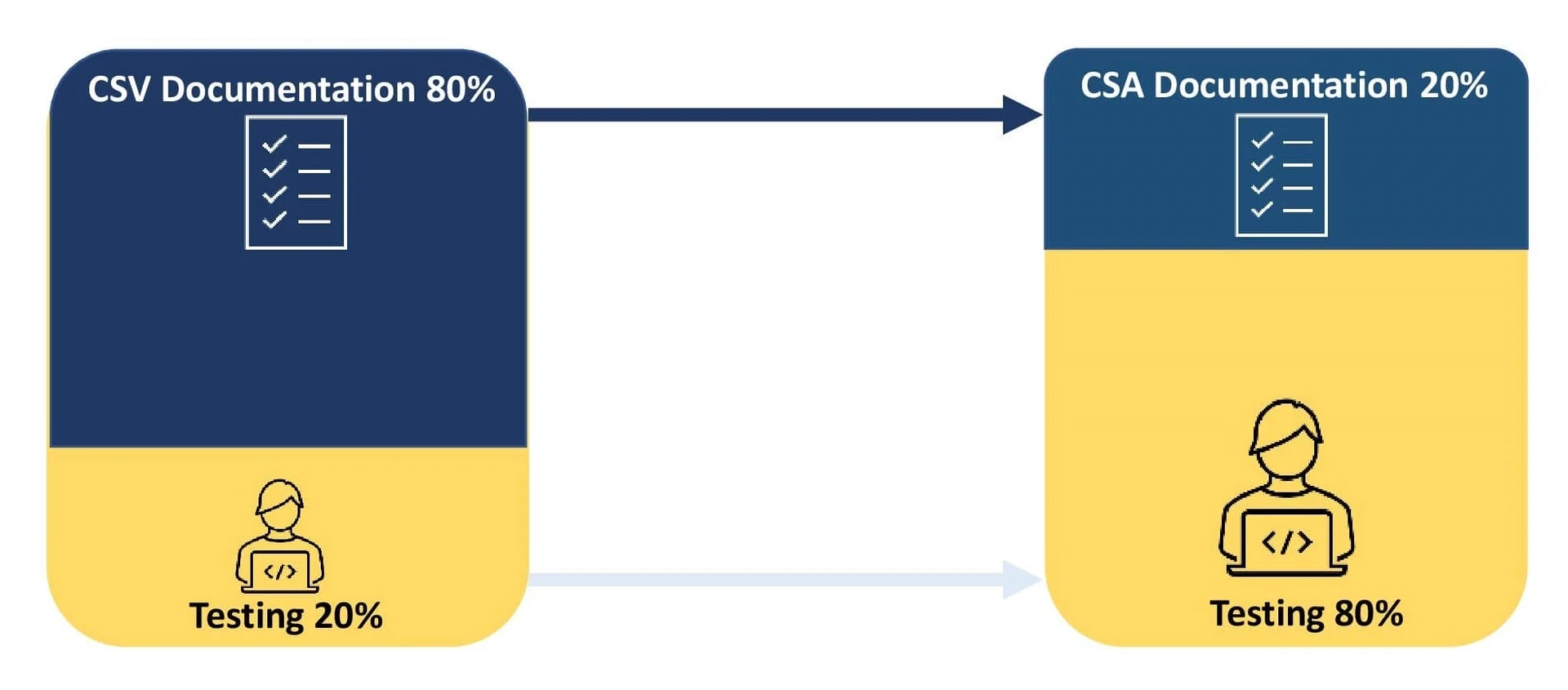
La validation des systèmes informatiques (CSV) est une approche documentée centrée sur la conformité qui sert de preuve pour garantir que le système est adapté à l'usage prévu.
Une organisation investit 80 % de ses efforts dans la documentation du processus de validation et 20 % dans les tests. Tout écart entre les résultats des tests du CSV et les résultats attendus doit être documenté et un plan d'action correctif doit être mis en œuvre.
L'assurance des logiciels informatiques (CSA) est une approche centrée sur la qualité qui met l'accent sur l'impact des systèmes logiciels sur la sécurité des patients, la qualité des produits et l'intégrité des données.
L'objectif principal est de se concentrer sur la validation et la documentation des activités à risque pour la sécurité en fonction de la complexité du logiciel. Une telle approche encourage l'utilisation de la numérisation et de l'automatisation, améliorant ainsi la qualité des produits. La réduction du processus de documentation aide les organisations à réagir aux problèmes logiciels critiques et à se conformer aux directives des autorités sanitaires. La CSA s'appuie sur les systèmes de qualité des fournisseurs pour réaliser des tests non scriptés afin de valider les systèmes à faible risque, ce qui permet aux organismes de consacrer 80 % de leurs efforts aux tests et 20 % à la documentation.
Par conséquent, les processus doivent être ajustés (modifiés) afin de refléter l'approche CSA à différentes étapes du SDLC, ce qui peut être réalisé en :
- Qualité par la conception (QbD) - En accordant la priorité à la sécurité des patients et à la qualité des produits, on s'assure que l'objectif principal du système logiciel installé est de répondre aux exigences des utilisateurs afin d'optimiser la qualité des produits.
- La stratégie de validation fondée sur le risque exige des essais et une documentation vigilants pour les systèmes sujets à des défaillances/défauts dans les cas de risque direct et moins dans les cas de risque indirect ou d'absence de risque.
- Le fait de repenser le ratio documents/tests permet aux promoteurs de redéfinir leur processus de validation en leur demandant de consacrer 80 % de leurs efforts aux tests et 20 % à la documentation.
- Fournir des avantages tangibles en relâchant la pression de la documentation.
Les personnes
Le facteur de différenciation entre CSV et CSA réside dans la hiérarchie de la stratégie. CSV observe une documentation suivie de tests et d'une réflexion critique, tandis qu'au contraire, CSA observe une réflexion critique comme première étape, suivie de tests et de documentation. CSV apporte des preuves documentées de l'efficacité et de l'efficience d'un système informatisé qui mène des activités conformément à des spécifications et à des attributs de qualité convenus à l'avance. D'autre part, la CSA recommande au commanditaire d'améliorer les processus de traçabilité afin de réduire les risques et les erreurs possibles.
Au niveau de la direction, élargissez le champ de la pensée critique en disposant de plusieurs moyens de faire face aux situations incertaines, car il n'y a pas "une" bonne façon d'accomplir quoi que ce soit. La pensée critique ouvrira des portes à l'innovation pour développer des produits fiables.
Au niveau de la pratique et de l'application, former les gens et les préparer à se transformer et à s'adapter à la CSA grâce à une collaboration efficace et à des programmes de formation efficaces.
Perspective technologique
Des directives complètes sur la CSV sont déjà en place, conformément aux exigences des autorités réglementaires telles que USFDA, EMA, MHRA et bien d'autres. Alors, avons-nous besoin de la CSA ? La réponse est oui. La CSA mettra en perspective l'objectif de la validation et clarifiera les divergences entre les promoteurs et les autorités sanitaires. Il existe des réglementations et des directives industrielles adéquates que les organisations pharmaceutiques doivent comprendre afin de tirer parti des avantages commerciaux en simplifiant l'approche du processus de validation. Le passage du CSV traditionnel au CSA fait passer la priorité de l'organisation de la conformité réglementaire à la qualité et à la sécurité des produits. Ce changement maximise l'effet du processus de validation en réduisant la charge documentaire importante, le calendrier du projet et les coûts pour les entreprises du secteur des sciences de la vie.
Aux niveaux stratégique et opérationnel, cet objectif peut être atteint en encourageant la numérisation et l'automatisation, en atténuant tous les risques possibles et les erreurs humaines.
Conclusion
Étant donné que les directivesFDA US sur la CSA n'ont pas encore été publiées, les organisations pharmaceutiques devraient commencer à réfléchir de manière proactive et à élaborer des protocoles pour passer de la CSV à la CSA. Les organisations doivent :
- Réévaluer et identifier les systèmes ayant un impact direct et indirect sur la sécurité des patients, la qualité des produits et l'intégrité des données.
- Allouer des ressources capables d'assurer une transition en douceur dans le processus de validation.
- Effectuer une analyse des lacunes par rapport au système existant afin d'identifier toute anomalie.
L'évaluation de l'approche de validation indique ce qu'une organisation peut faire pour apporter des changements lorsqu'elle rencontre un problème dans le système. L'exécution correcte du processus CSV exige une compréhension approfondie du système et des idées sur la manière de l'utiliser.
Il est aujourd'hui indispensable pour les organisations de s'associer à des experts CSV capables de modérer des projets simples ou complexes et de faciliter la transition entre CSV et CSA. Un cadre d'évaluation de la qualité minimise les retouches dans le processus de validation des produits et des fournisseurs afin de garantir une conformité et une validation totales à chaque étape du déploiement, de la maintenance et de la mise hors service, à un prix extrêmement compétitif. Reach Freyr la conformité.









