Services de conformité, d'audit et de validation - Aperçu
Êtes-vous conforme ? C'est une question à laquelle toute entreprise pharmaceutique, biotechnologique, génomique, chimique, de dispositifs médicaux et de gestion de la chaîne d'approvisionnement a du mal à répondre. Ces organisations doivent se conformer à des exigences strictes en matière de qualité, de sécurité et de conformité dans chaque région où leurs produits sont distribués. La tendance actuelle en matière de gestion de la conformité réglementaire est à l'harmonisation mondiale de la qualité et de la sécurité. Que vous soyez fabricant ou fournisseur, votre expansion sur le marché, votre amélioration continue et la satisfaction de vos clients reposent principalement sur les normes de qualité de votre entreprise. Le centre d'excellence de Freyren matière de conformité réglementaire, d'audit et de validationCoE peut contribuer à cet effort en vous offrant des services professionnels de conformité, d'audit et de validation pour les produits pharmaceutiques, les dispositifs médicaux, les produits de consommation et les industries de la santé, tels que les BPF (bonnes pratiques de fabrication), les BPC (bonnes pratiques cliniques), les GDP (bonnes pratiques de distribution), les bonnes pratiques de laboratoireGLP), les GPVP (bonnes pratiques de pharmacovigilance) et la validation des systèmes informatiques GxP (CSV).
Freyr fournit des services de conformité réglementaire, d'audit et de validation qui impliquent l'évaluation de vos exigences et la suggestion d'apports aux processus d'entreprise conçus pour assurer la satisfaction du client. Grâce à nos stratégies de préparation des rapports d'audit de conformité, nous fournissons des rapports de conformité et d'audit (analyse des écarts), y compris des suggestions d'actions correctives et préventives (CAPA) afin d'éviter d'éventuelles 483 et conclusions d'audit de conformité de la part des autorités de réglementation.
Nous fournissons des services de conformité réglementaire et de validation pour garantir que tous vos processus et produits sont alignés sur les exigences applicables en matière de qualité, de sécurité de l'information et d'audit de conformité réglementaire, telles que (mais sans s'y limiter) les suivantes :
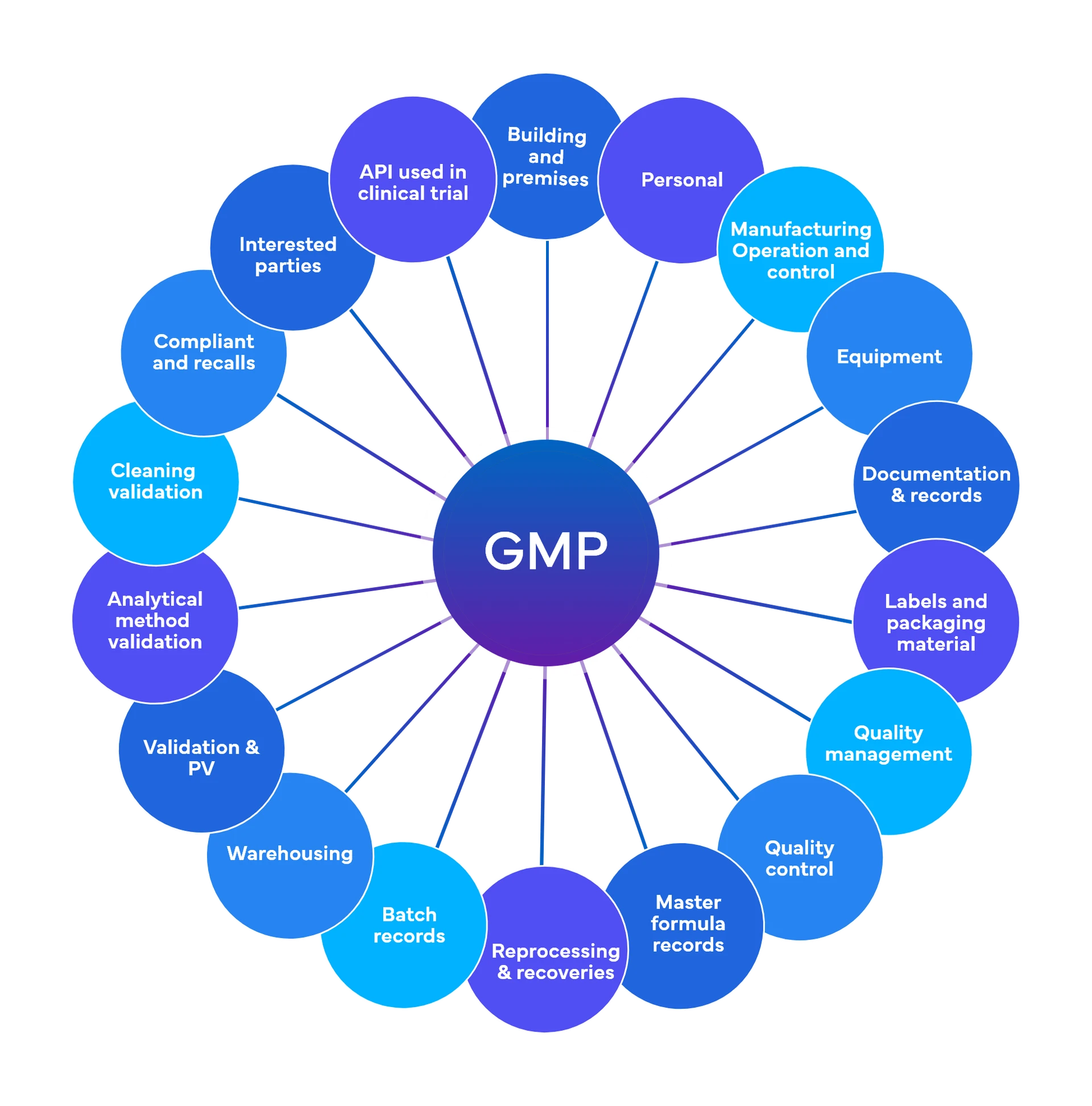
Freyr effectue environ 700 contrôles à un niveau préliminaire, répartis entre 18 et 19 domaines fonctionnels des BPF.
Conformité, audit et validation de Freyr
Services de conformité, d'audit et de validation
Qualité et conformité réglementaire - Bonnes pratiques de fabrication actuelles (BPF)
- ISO / CEI 17025 : 2017 - Exigences générales concernant la compétence des laboratoires d'étalonnages et d'essais
- OCDE (Organisation de Co et de développement économiques) - Lignes directrices relatives aux bonnes pratiques de laboratoire
- Guide EURACHEM / CITAC : Guide to Quality in Analytical Chemistry - An Aid to Accreditation, 3rd Edition (2016), doit être suivi dans les procédures analytiques.
- 21 CFR 58 : Bonnes pratiques de laboratoire pour les études de laboratoire non cliniques
- Guide to UK GLP Regulations, Feb 2000 (par GLPMA)
- Manuel de WHO sur les bonnes pratiques de laboratoireGLP: Pratiques de qualité pour la recherche et le développement non cliniques réglementés
- Health Canada: Ligne directrice finalisée - Données d'études non cliniques en laboratoire à l'appui des demandes et des présentations de drogues : Respect des bonnes pratiques de laboratoire
- Normes OSHA (Occupational Safety and Health Administration)
- Lignes directrices ICH applicables
Bonnes pratiques de laboratoire
- ISO / CEI 17025 : 2017 - Exigences générales concernant la compétence des laboratoires d'étalonnages et d'essais
- OCDE (Organisation de Co et de développement économiques) - Lignes directrices relatives aux bonnes pratiques de laboratoire
- Guide EURACHEM / CITAC : Guide to Quality in Analytical Chemistry - An Aid to Accreditation, 3rd Edition (2016), doit être suivi dans les procédures analytiques.
- 21 CFR 58 : Bonnes pratiques de laboratoire pour les études de laboratoire non cliniques
- Guide to UK GLP Regulations, Feb 2000 (par GLPMA)
- Manuel de WHO sur les bonnes pratiques de laboratoireGLP: Pratiques de qualité pour la recherche et le développement non cliniques réglementés
- Health Canada: Ligne directrice finalisée - Données d'études non cliniques en laboratoire à l'appui des demandes et des présentations de drogues : Respect des bonnes pratiques de laboratoire
- Normes OSHA (Occupational Safety and Health Administration)
- Lignes directrices ICH applicables
Bonnes pratiques cliniques (BPC) et bonnes pratiques de pharmacovigilance (BPV)
- Directive tripartite harmonisée de ICH : Lignes directrices pour les bonnes pratiques cliniques - E6
- E2B(R3) Spécification du rapport individuel de sécurité (RIS) et fichiers connexes
- E2C(R2) Rapport périodique d'évaluation des risques et des prestations (PBRER)
- Autres lignes directrices ICH applicables
- Modules sur les bonnes pratiques de pharmacovigilance (BPV)
- Exigences de FDA en matière de rapports de sécurité pour les IND et les études BA/BE
- Rapports de sécurité post-commercialisation pour les médicaments humains et les produits biologiques, y compris les vaccins
- FDA Regional Implementation Specifications for ICH E2B(R3) Reporting to the FDA Adverse Event Reporting System (FAERS) (spécifications régionales de mise en œuvre de l'ICH E2B(R3))
- Fournir des soumissions en format électronique - Questions et réponses techniques sur les ICSR non expédiés après la mise sur le marché
- Planification de la pharmacovigilance E2E
Sécurité de l'information, confidentialité des données et validation des systèmes informatiques (CSV)
- ISO 27001: 2013 Technologies de l'information - Techniques de sécurité - Système de management de la sécurité de l'information - Exigences
- ISO 27002 : 2013 Technologies de l'information - Techniques de sécurité - Code de bonne pratique pour la gestion de la sécurité de l'information
- USFDA 21 CFR Part 11: Enregistrements électroniques ; Signatures électroniques - Portée et application
- Guide des BPF de l'UE, annexe 11
- Notification de la ligne directrice japonaise ERES n° 0401022
- GAMP 5 : Une approche basée sur le risque pour des systèmes informatisés GxP conformes
- USFDA - Directives de validation des logiciels
- Lignes directrices ICH QSEM applicables
- Planifier et créer des procédures opératoires normalisées et contrôler les installations de fabrication
- Modèle de processus intégré
- Maintenir l'image de marque
- Services d'évaluation des risques
- Réduction globale des coûts
- Mettre en œuvre des processus opérationnels efficaces et conformes
- Établir des stratégies de validation et de qualification
- Expertise en matière de conformité réglementaire et d'audit
- Auditeurs experts en matière de conformité


 Services de conformité et d'audit
Services de conformité et d'audit







