Vue d'ensemble des dispositifs médicaux combinés
Dans le monde dynamique des soins de santé et de l'innovation, les produits combinés de dispositifs médicaux sont devenus un pont solide reliant les produits pharmaceutiques, les dispositifs médicaux et les produits biologiques. Le marché des produits combinés est en plein essor, avec un taux de croissance annuel composé (TCAC) prévu de 8,9 % entre 2023 et 2030. Le secteur des produits combinés médicaments-dispositifs est prêt à connaître une croissance soutenue, soutenue par les avancées technologiques, l'amélioration des infrastructures de soins de santé, des voies réglementaires plus fluides, des collaborations stratégiques et un engagement en faveur de soins centrés sur le patient.
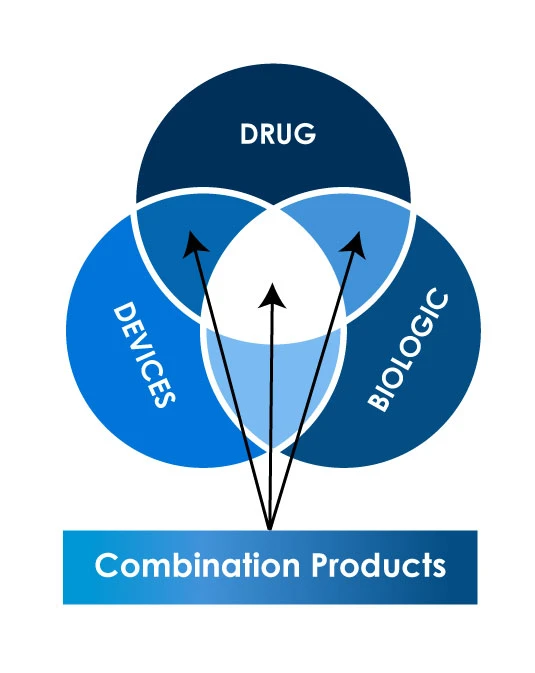
Différents types de produits combinés
Scénario réglementaire mondial pour l'enregistrement des produits combinés
L'interprétation de ce qui constitue un produit combiné peut varier d'un pays à l'autre, ce qui complique l'enregistrement de ces produits dans différents pays. En outre, les exigences et les procédures réglementaires relatives aux produits combinés peuvent présenter des variations en matière de documentation, de communication et de validation. Le paysage réglementaire pour l'enregistrement des produits combinés peut être très différent d'un pays à l'autre. Voici les principales autorités réglementaires who supervisent ces dispositifs à l'échelle mondiale.
| Pays | Agence | Centres pilotes pour l'approbation |
|---|---|---|
| ÉTATS-UNIS | Office des produits combinés (OCP) | Centre d'évaluation et de recherche sur les médicaments (CDER) |
| Centre d'évaluation et de recherche sur les produits biologiques (CBER) | ||
| Centre des dispositifs et de la santé radiologique (CDRH) | ||
| L'UE | Organismes notifiés (ON) | Autorité nationale compétente (Produits médicaux) |
| Organismes notifiés (ON) (dispositifs médicaux) | ||
| Japon | Division de l'évaluation et des licences ou bureau des dispositifs médicaux/produits cellulaires et tissulaires du bureau de la sécurité pharmaceutique et alimentaire. | Directeur de la Division de l'évaluation et des licences (DMDL), Bureau de la sécurité pharmaceutique et alimentaire, Bureau de la sécurité pharmaceutique et médicale, Ministère de la santé et des affaires sociales |
| Chine | Centre d'administration de la normalisation des dispositifs médicaux (CMDSA) | Centre d'évaluation des dispositifs médicaux (CMDE) |
| Centre d'évaluation des médicaments (CDE) | ||
| Malaisie | Agence nationale de réglementation pharmaceutique | Agence nationale de réglementation pharmaceutiqueNPRA |
| Agence des dispositifs médicaux |
L'enregistrement des produits combinés sur les marchés internationaux nécessite une approche sur mesure, impliquant une étroite collaboration avec les agences de santé compétentes pour l'approbation. Le processus habituel d'enregistrement des produits combinés comprend les étapes suivantes :
- Évaluer si un dispositif spécifique répond aux critères de classification en tant que produit combiné.
- Classer les appareils en fonction des risques associés.
- Identifier les normes pertinentes et les conditions préalables en matière de données spécifiées par l'agence de santé concernée.
- Générer les données nécessaires selon le mandat de l'Agence.
- Constitution d'un dossier technique conformément aux exigences spécifiques de chaque pays.
- Soumettre la demande et répondre à toute question ou préoccupation jusqu'à ce que l'approbation soit obtenue.
- Gestion du cycle de vie du dispositif après l'approbation.
Nos compétences
- Analyse initiale des risques
- Études de marché - Informations sur les marchés spécifiques aux produits
- Augmentation du personnel
- Projet de stratégie réglementaire
- Marchés et itinéraires potentiels
- Dossier de conception et analyse des risques
- Quality Management System (QMS) ISO 13485
- Medical Device Single Audit Program MDSAP
- Pré-évaluation du SMQ ISO 13485
- Stratégie réglementaire
- Freyr IMPACT (plateforme d'intelligence réglementaire)
- Vérification et validation de la conception
- Gestion des risques
- Rédiger la documentation technique
- Stratégie réglementaire
- Exigences réglementaires
- Outil Freyr rDMS (Système de gestion des données et de la documentation)
- Validation des processus et validation clinique
- Étiquetage final et artwork
- Représentation dans le pays
- Soumission réglementaire
- Le marquage "Conformité européenne" (CE) de l'Union européenne (UE) et le marquage "UK Conformity Assessment" (UKCA).
- Certification de l'accès au marché mondial
- Soutien à l'audit des organismes notifiés (ON) et des organismes agréés
- Représentation dans le pays
- Approbations réglementaires
- Post-market Surveillance (PMS)
- Suivi clinique après la mise sur le marché (PMCF)
- Mise à jour annuelle du dossier technique (CER/Gestion des risques)
- Renouvellements réglementaires
- Lancement de nouveaux marchés
- Communication de l'autorité compétente/de l'organisme notifié/agréé
- Solutions automatisées de pharmacovigilance (PV)
Pourquoi Freyr?
Enregistrement des dispositifs médicaux
- Stratégie réglementaire complète pour les produits combinés.
- Soutien réglementaire pour les documents de développement de produits tels que les dossiers historiques de conception (DHF).
- Stratégie de conformité au SMQ.
- Conformité réglementaire, analyse des lacunes et remédiation des documents techniques et des systèmes de qualité.
- Services d'étiquetage réglementaire et de rédaction technique.
- Services d'information sur la réglementation et le marché.
- Services de traduction de documents et d'étiquettes.
- Liaison avec l'agence de santé et service.
- artwork réglementaire.
- Services de pharmacovigilance et de PMS.
- Services d'édition.
- Services de rédaction médicale.

- Soumissions réussies pour diverses classes de DIV.
- Un personnel spécialisé et dévoué pour fournir une assistance réglementaire en matière de dispositifs médicaux et de DIV.
- Soumission des produits dans les délais impartis.
- Accès aux affiliés locaux pour répondre aux défis de l'Autorité et aux exigences linguistiques spécifiques.
- Soutien au pays ou aux représentants légaux selon un modèle rentable.
- Services de gestion des ressources réglementaires et d'augmentation du personnel.





