Vue d'ensemble de l'approbation préalable à la mise sur le marché des dispositifs médicaux USFDA
Le processus d'autorisation USFDA (PMA) USFDA est l'une des voies d'enregistrement des dispositifs proposées par laFDA US , principalement conçue pour les dispositifs médicaux FDA III FDA . Le processus d'autorisation FDA pour les dispositifs de classe III implique des évaluations scientifiques et réglementaires minutieuses afin d'évaluer la sécurité et l'efficacité du dispositif médical, garantissant ainsi le respect des normes les plus strictes avant l'autorisation de mise sur le marché.
Prenez rendez-vous avec nos experts en autorisation de mise sur le marché
Who doit soumettre une demande d'autorisation de mise sur le marché (PMA) pour un dispositif médical USFDA ?
Les fabricants de dispositifs doivent soumettre une demande d'autorisation de mise sur le marché (PMA) si le dispositif :
- Est un roman.
- Appartient à une classe à haut risque.
- Introuvable dans la base de données de classification des produits.
- N'est pas substantiellement équivalent (NSE) aux dispositifs de classe I, II ou III.
Obtenez des conseils d'experts sur votre demande d'autorisation de mise sur le marché
Quelle est la différence entre les demandes 510(k), PMA et De-Novo ?
Approbation préalable à la mise sur le marché
- Dispositif relevant de la classe III qui maintient la vie humaine ou qui présente un risque potentiel et déraisonnable de maladie ou de blessure.
- La procédure d'approbation PMA de FDA nécessite des essais cliniques.
- Exige une inspection sur place avant de délivrer l'agrément PMA.
- 180 jours calendaires
Classification De-Novo
- Nouveaux dispositifs des classes I et II qui n'ont pas de dispositif prédicat valide.
- Nécessite des données d'études cliniques.
- Pas d'audit sur place avant l'approbation De-Novo.
- 150 jours calendaires.
Enregistrement 510(k)
- Les dispositifs de classe III de FDA qui ont une équivalence substantielle avec le dispositif prédicat.
- Il ne nécessite pas d'essais sur l'homme.
- Pas d'audit sur place avant l'autorisation 510(k).
- 90 jours calendaires.
Quelles sont les différentes méthodes de demande d'autorisation de mise sur le marché FDA ?
Les fabricants peuvent opter pour l'une des quatre (04) méthodes d'application de la PMA qui conviennent le mieux à leur dispositif :
- PMA traditionnel
- PMA modulaire
- Protocole de développement de produits
- Exemption pour les dispositifs humanitaires
Quelles sont les exigences en matière de données pour l'approbation préalable à la mise sur le marché d'un dispositif médical ?
Conformément à la norme 21 CFR partie 814, les demandeurs doivent soumettre à laFDA US un formulaire de demande CDRH dûment rempli, les engagements requis et un dossier technique PMA bien rédigé. Le dossier technique doit inclure les données non cliniques et cliniques.
Données non cliniques - Il s'agit de données sur la microbiologie, la toxicologie, l'immunologie, la biocompatibilité, le stress, l'usure, la durée de conservation et d'autres essais en laboratoire ou sur des animaux.
Données cliniques - Il s'agit de données sur les protocoles d'étude, les données relatives à la sécurité et à l'efficacité, les effets indésirables et les complications, les défaillances et les remplacements de dispositifs, les informations sur les patients, les plaintes des patients, les tableaux de données de tous les sujets individuels, les résultats des analyses statistiques et toute autre information provenant des investigations cliniques.
En quoi consiste la procédure de demande d'autorisation de mise sur le marché (PMA) ?
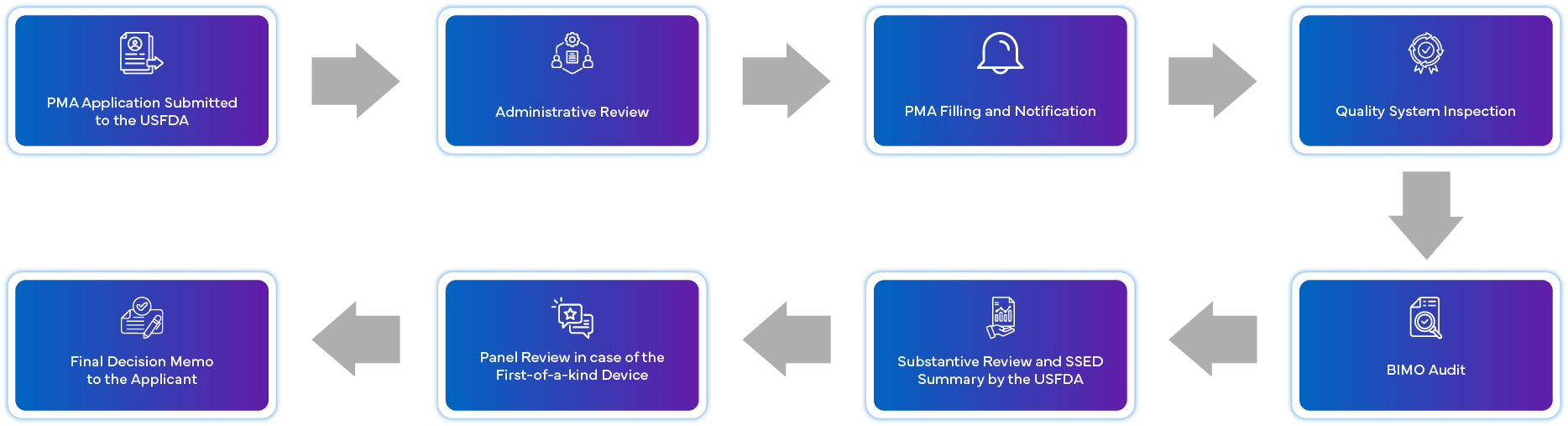
Quelles sont les exigences de conformité post-approbation pour la PMA ?
Les dispositifs approuvés dans le cadre de la procédure d'autorisation de mise sur le marché (PMA) doivent être conformes aux exigences post-commercialisation définies par l'USFDA. Le dispositif doit être conforme aux éléments suivants :
- Exigences post-approbation imposées dans l'ordonnance d'approbation PMA de FDA .
- Gestion des changements post-approbationpar la soumission en temps utile des suppléments pertinents à l'autorisation de mise sur le marché (PMA)
- Soumission de rapports post-approbation (annuels)
- Réglementation 21 CFR 803 pour les rapports sur les dispositifs médicaux (MDR)
- les études de surveillance post-commercialisationexigées par l'USFDA dans les ordonnances d'approbation de l'autorisation de mise sur le marché.
Quels sont les frais de l'USFDA pour l'examen de la demande d'autorisation de mise sur le marché (PMA) ?
Les frais d'utilisation de la MDUFA pour la PMA originale et les suppléments sont les suivants
| Type d'application | Droits pour l'année fiscale 2023 (du supsupoctobre 2022 au sup septembre | |
|---|---|---|
| Taxe standard | Taxe sur les petites entreprises | |
| PMA, PDP, PMR, BLA | $441,547 |
|
| Supplément pour les panneaux et les pistes | $353,238 | $88,309 |
| Supplément de 180 jours | $66,232 | $16,558 |
| Taxe annuelle pour les rapports périodiques sur les dispositifs de classe III (PMA, PDP et PMR) | $15,454 | $3,864 |
| Avis de 30 jours | $7,065 | $3,532 |
| Supplément en temps réel | $30,908 | $7,727 |
Grâce à son expertise dans le traitement des demandes d'autorisation de mise sur le marché, Freyr peut contribuer à l'identification et à la compilation des informations, ainsi qu'à la préparation et à l'examen de la demande.
Expertise et avantages de l'USFDA en matière d'approbation préalable à la mise sur le marché de dispositifs médicaux
- Diligence réglementaire
- Conformité de l'inspection du système de qualité
- Conformité de l'audit BIMO
- Compilation des dossiers techniques de l'APM
- Publication et création d'une copie électronique
- Validation et soumission de la copie électronique
- Réponse et lacunes du CRT
- Services de liaison jusqu'à l'approbation de précommercialisation de FDA
- Consultation sur les déficiences
- Liste des dispositifs et enregistrement des établissements
- Gestion des suppléments à l'autorisation de mise sur le marché (PMA) et des avis de 30 jours
- Rapports périodiques annuels
- Audits fictifs et 21 CFR 820 Formation

- Expérience dans le traitement de nombreuses demandes d'autorisation de mise sur le marché (PMA) de FDA pour des catégories de dispositifs diversifiées.
- Équipe d'experts pour la demande d'autorisation de mise sur le marché de FDA conformément aux exigences réglementaires
- Un soutien supplémentaire pour traiter les questions relatives à l'AMP.
- Soumission des produits dans les délais impartis
- Conforme auxFDA modifications apportées par laFDA US
