Évaluation des performances des dispositifs médicaux - Vue d'ensemble
Le marché des Software as a Medical Device (SaMD) est en plein essor à l'échelle mondiale en raison de facteurs tels que la demande croissante de services de santé à distance et les innovations à venir dans le domaine de la santé numérique. En Europe, le marché du SaMD devrait croître d'environ 27,1 % au cours de la période 2021-2027.
Le logiciel SaMD tant que dispositif médical comprend un dispositif médical de diagnostic in vitro (DIV). Il est essentiel de souligner que la réglementation de l'UE n'emploie pas le termeSoftware as a Medical Device SaMD)". Elle utilise plutôt le terme "Medical Device Software", abrégé en MDSW.
Dans l'Union européenne (UE), les SaMD sont régis par le règlement relatif aux dispositifs médicaux (MDR) 2017/745 et le règlement relatif aux diagnostics in vitro (IVDR) 2017/746. Ces règlements fournissent un cadre pour garantir la sécurité et la performance des dispositifs médicaux, y compris les DMD, sur le marché de l'UE.
Comment un logiciel peut-il être considéré comme un dispositif médical ?
Pour déterminer si votre dispositif est considéré comme SaMD par l'UE, vous devez évaluer si le logiciel est destiné à être utilisé pour une (01) ou plusieurs fins médicales sans faire partie d'un dispositif médical matériel. Si votre logiciel fonctionne seul pour répondre à une finalité médicale, il peut être qualifié de SaMD.
Toutefois, s'il est destiné à piloter un dispositif médical matériel ou s'il en fait partie intégrante, il ne sera pas considéré comme un logiciel autonome et ne sera donc pas SaMD. Veillez toujours à ce que votre produit soit conforme aux dernières réglementations et lignes directrices de l'UE en matière de dispositifs médicaux.
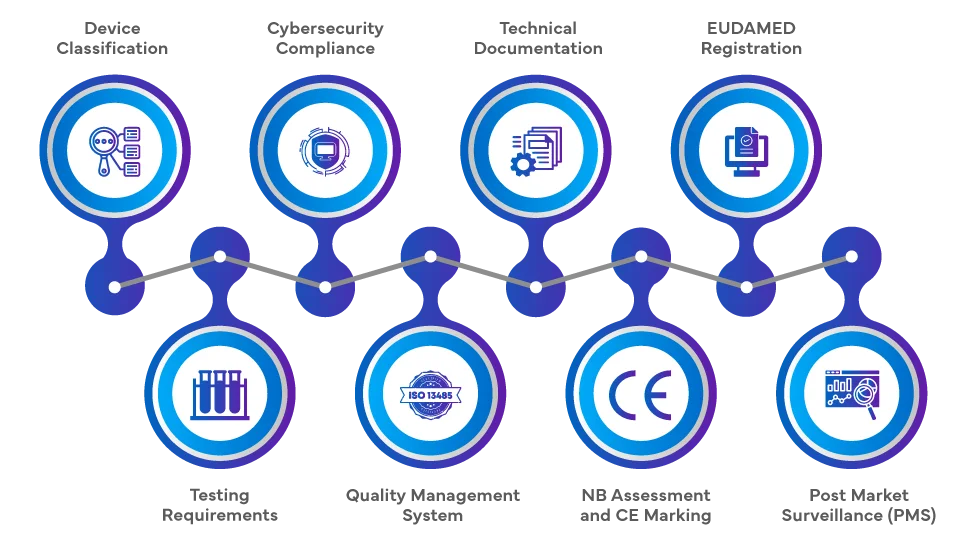
Comment enregistrer votre SaMD dans l'UE ?
La procédure réglementaire pour l'introduction SaMD le marché européen en vertu EU MDR et EU MDR IVDR 2017/746 EU MDR comprend une série complète d'étapes. Les fabricants doivent classer le produit logiciel en fonction de son objectif et de son niveau de risque, puis procéder à une évaluation de la conformité, qui peut impliquer un organisme notifié (ON) pour les classes à haut risque. La documentation technique, l'évaluation clinique et le respect des systèmes de gestion de la qualité (SGQ) sont essentiels. Une fois l'évaluation réussie, le marquage CE est apposé et l'enregistrement dans la base de données européenne sur les dispositifs médicaux (EUDAMED) est nécessaire. Post-market Surveillance (PMS) continue Post-market Surveillance (PMS), la vigilance et le respect des exigences en matière de cybersécurité complètent le parcours réglementaire.
Foire aux questions (FAQ)
Un certificat EU MDR est un document délivré par un ON désigné à la suite d'une évaluation de la conformité en vertu du règlement de l'Union européenne relatif aux dispositifs médicauxEU MDR 2017/745) ou du règlement relatif aux diagnostics in vitro (IVDR) 2017/746. Ce certificat vérifie qu'un dispositif médical répond aux exigences énoncées dans le EU MDR, qui comprend des normes de sécurité, de performance et de qualité. Le certificat est nécessaire pour que les dispositifs médicaux / dispositifs de diagnostic in vitro puissent être légalement commercialisés au sein de l'UE.
Dans l'UE, les dispositifs médicaux sont classés en quatre (04) classes de risque : Classe I, Classe IIa, Classe IIb et Classe III. La classe I représente les dispositifs présentant le risque le plus faible, et la classe III comprend les dispositifs présentant le risque le plus élevé. La classification tient compte de facteurs tels que le caractère invasif du dispositif, la durée d'utilisation, la partie du corps affectée et les risques potentiels associés à la conception technique et à la fabrication du dispositif.
De la même manière, les SaMD sont également classés en fonction du risque qu'ils représentent pour les patients et les utilisateurs, allant d'un risque faible (classe I) à un risque élevé (classe III).
On parle deSoftware as a Medical Device "SaMD) lorsque le logiciel est conçu pour une (01) ou plusieurs fins médicales et qu'il exécute ces fonctions de manière indépendante, sans faire partie intégrante d'un dispositif médical matériel. D'autre part, on parle de "logiciel dans un dispositif médical" (SiMD) lorsque le logiciel est intégré dans un équipement médical, connu sous le nom de logiciel embarqué ou de micrologiciel.
Il est essentiel de souligner que la réglementation européenne n'emploie pas l'expressionSoftware as a Medical Device". Elle utilise plutôt le terme "Medical Device Software", abrégé en MDSW.
"Logiciel de dispositif médical (MDSW)" désigne un logiciel destiné à être utilisé, seul ou en combinaison, dans un but décrit dans la définition d'un "dispositif médical" conformément aux EU MDR 2017/745 et EU IVDR 2017/746.
Le temps nécessaire à l'homologation d'un SaMD dans l'UE peut varier considérablement en fonction de plusieurs facteurs. Les principaux déterminants sont la classification du dispositif, sa complexité, la voie d'évaluation de la conformité, l'implication d'un ON et l'efficacité du processus de soumission réglementaire.
Enregistrement SaMD dans les autres marchés (UE/Australie/Corée) pour les dispositifs médicaux
- Stratégie réglementaire globale de EU MDR en matière de EU MDR pour les SaMD.
- Soutien à la réglementation et à l'intelligence économique.
- Services de classification et d'enregistrement des produits pour les ministères de la santé.
- Soutien réglementaire pour les documents de développement des produits SaMD .
- Services de consultation sur les études d'évaluation clinique de SaMD .
- Gestion des changements post-approbation.
- Services EAR/UKRP/CH-Rep.

- Soumissions réussies pour différentes classes de SaMD.
- Un personnel spécialisé et expert pour fournir une assistance en matière de réglementation.
- Soumission des produits dans les délais impartis.
- Accès aux affiliés locaux pour répondre aux défis des Health Authority (HA) et aux exigences linguistiques spécifiques.
- Soutien dans le pays ou au représentant légal (RL), avec un modèle rentable.
- Services de gestion des ressources réglementaires et d'augmentation du personnel.





