Aperçu de l'enregistrement des instruments Health Canada
Le Canada, avec ses lignes directrices très strictes, possède l'un des meilleurs systèmes de réglementation au monde pour les dispositifs médicaux. Au Canada, tous les dispositifs médicaux sont réglementés par Health Canada, Direction générale des produits de santé et des aliments, Direction des produits thérapeutiques, Bureau des dispositifs médicaux. Health Canada examine les dispositifs médicaux afin d'évaluer leur sécurité, leur efficacité et leur qualité avant d'autoriser leur vente au Canada, conformément à la réglementation canadienne sur les dispositifs médicaux (DORS/98-282), mise en œuvre en 1998. Freyr a été un partenaire actif des entreprises de dispositifs médicaux pour les aider à se conformer aux directives d'enregistrement des dispositifs médicaux de Health Canada .
Autorité de régulation : Health Canada
Règlement : Règlement sur les dispositifs médicaux (DORS/98-282)
Représentant autorisé : Non requis
Exigence du SMQ : Conformité à la ISO 13485:2016 comme Medical Device Single Audit Program MDSAP
Évaluation des données techniques : Health Canada
Validité de la licence : Illimité
Exigences en matière d'étiquetage : Partie 21 du MDR (DORS/98-282)
Format de soumission : Papier
Langue : Anglais et français
Classification des instruments Health Canada
Le système de classification des instruments Health Canada s'inspire largement de la directive 93/42/CEE du Conseil de l'Union européenne. Bon nombre des règles et interprétations des termes sont similaires à celles proposées par l'Union européenne. Cependant, il n'est pas certain qu'un instrument médical classé dans une catégorie selon le système de classification de l'Union européenne sera classé dans la même catégorie selon le système de classification des instruments médicaux du Canada. Le demandeur doit suivre les règles énoncées dans le Règlement afin de déterminer la classification appropriée pour son instrument au Canada.
Les indicateurs suivants du risque posé par un dispositif donné ont été utilisés pour créer les règles de classification canadiennes : degré d'invasivité, durée du contact, système corporel affecté et effets locaux par rapport aux effets systémiques.
| Classe d'appareil | Risque |
|---|---|
| I | Faible |
| II | Faible-modéré |
| III | Élevée-Modérée |
| IV | Haut |
Canada Représentant autorisé
Le fabricant n'est pas tenu de désigner un représentant autorisé au Canada. Le distributeur doit toutefois se conformer aux Health Canada en matière de bonnes pratiques de distribution (GDP).
Enregistrement des dispositifs médicaux - Canada
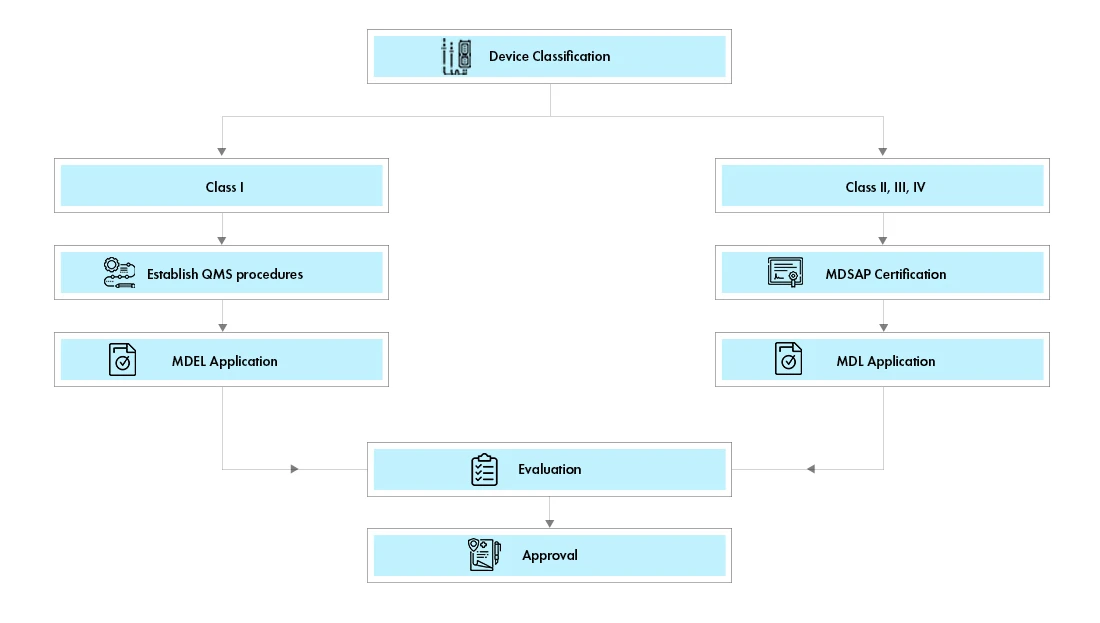
Il existe deux voies pour l'enregistrement des dispositifs médicaux au Canada :
Licence d'établissement de dispositifs médicaux (MDEL):Les dispositifs de classe I peuvent faire l'objet d'une demande de licence d'établissement de dispositifs médicaux au Canada (MDEL) en préparant les procédures obligatoires et en acquittant Health Canada .
Licence de dispositif médical (MDL) : Les dispositifs de classe II, III et IV doivent faire l'objet d'une demande d'homologation de dispositif médical (MDL) au Canada. Les exigences en matière de documents varient d'une classe à l'autre.
Déroulement du processus
Gestion du cycle de vie des appareils après leur approbation
Freyr les fabricants étrangers dans la gestion end-to-end du cycle de vie des dispositifs end-to-end , y compris les activités post-autorisation, telles que :
- Gestion des modifications après approbation - modifications des approbations de dispositifs médicaux existants, telles que l'ajout de nouvelles variantes, d'accessoires, l'ajout de nouvelles indications d'utilisation, etc.
- Maintien des agréments et de l'enregistrement par le paiement en temps voulu des frais administratifs et d'enregistrement
- Renouvellement des licences
- Assurer la liaison entre Health Canada le fabricant
Résumé
| Risque | Classe d'appareil | Audit du SMQ | Voie réglementaire | Exigences en matière de documents | Health Canada |
|---|---|---|---|---|---|
| Faible | I | NA | MDEL |
| NA |
| Faible-modéré | II | MDSAP | MDL |
| 15 jours |
| Élevée-Modérée | III | MDSAP | MDL |
| 60 jours |
| Haut | IV | MDSAP | MDL |
| 75 jours |
Services d'enregistrement des dispositifs médicaux de Freyr
Expertise Freyr
- Services de classification et de regroupement des instruments Health Canada
- Enregistrement des dispositifs médicaux, Canada
- Réunions préalables à la soumission avec Health Canada
- MDSAP, Canada
- Identification du distributeur/Qualification du distributeur pour la conformité aux Health Canada
- Licence d'établissement pour les dispositifs médicaux Canada (MDEL)
- Homologation des dispositifs médicaux au Canada (MDL)
- Gestion des changements après approbation
- Services d'étiquetageconformément aux exigences Health Canada pour les instruments médicaux