Rapport de validité scientifique (RVS)
Le rapport de validité scientifique (SVR) revêt une importance capitale au sein du rapport d'évaluation des performances (PER) des dispositifs de diagnostic in vitro (DIV), conformément au règlement de l'Union européenne relatif au diagnostic in vitro (EU IVDR) 2017/746. Le RVS joue un rôle crucial dans la validation scientifique des performances analytiques et cliniques du dispositif, garantissant la sécurité et l'efficacité des dispositifs médicaux disponibles sur le marché. Dans le cadre du processus d'évaluation de la conformité prescrit par le règlement IVDR de l'UE, les fabricants sont tenus de présenter un PER, qui doit inclure un SVR, à un organisme notifié afin de démontrer la sécurité et les performances du dispositif avant son introduction sur le marché de l'UE.
Rapports de validité scientifique pour la soumission de l'IVDR de l'UE
- Analyse et conclusions
Quel est le contenu du rapport de validité scientifique (RVS) ?
La validité scientifique d'un analyte signifie l'association d'un analyte avec une condition clinique ou un état physiologique. La validité scientifique d'un DIV est principalement basée sur l'une des sources suivantes ou sur une combinaison de celles-ci :
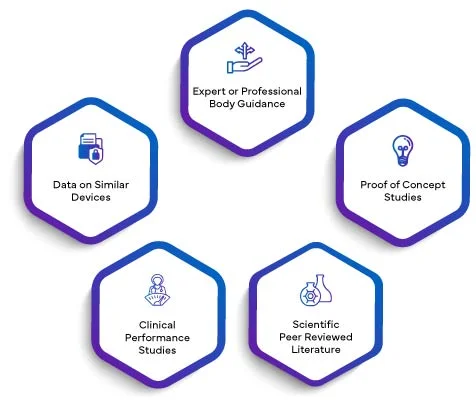
Les données de tous les éléments ci-dessus, le cas échéant, seront rédigées dans un rapport de validité scientifique. En intégrant le SVR dans le PER, les fabricants élèvent leur évaluation des performances à un niveau supérieur de crédibilité. La validité scientifique établie par le SVR confère au PER une base solide, améliorant ainsi sa qualité et son importance globales. Ceci, à son tour, inspire confiance aux organismes de réglementation, aux professionnels de la santé et aux utilisateurs finaux, en garantissant que la performance du DIV est méticuleusement évaluée et validée conformément aux exigences strictes de l'EU IVDR 2017/746.
Freyr offre une assistance complète pour la préparation d'un solide rapport de validité scientifique (SVR) pour les DIV, vous permettant de naviguer en toute confiance dans le paysage réglementaire et d'introduire en toute transparence des dispositifs de DIV sûrs et efficaces sur le marché.
Rapport de validité scientifique
- Plan de transition pour la mise en conformité avec l'IVDR.
- Rapport de validité scientifique (SVR) basé sur la littérature et/ou les données internes.
- Rapports de performance clinique (RPC) basés sur la littérature et/ou les données internes.
- Rapports de performance analytique (APR)
- Preuves cliniques ou rapports d'évaluation des performances conformément à l'IVDR.
- Plan d'évaluation des performances.
- Protocoles et rapports de suivi des performances post-marché (PMPF).
- Protocoles et rapports de surveillance post-marché (PMSR).
- Rédiger/réviser d'autres documents, tels que la notice d'emballage/IFU, les instructions de référence rapide (QRI), le manuel d'utilisation/de fonctionnement, etc.

- Assurer la conformité avec les récentes réglementations applicables.
- Équipe d'experts qualifiés
- Des solutions adaptées à vos besoins
- Gestion des ressources réglementaires/Services de renforcement du personnel
- Contributions interfonctionnelles d'experts en dispositifs médicaux pour se conformer aux exigences.