Clinical evaluation report (CER) pour les dispositifs médicaux Vue d'ensemble
Tout dispositif destiné à être commercialisé dans l'Union européenne (UE) doit porter un marquage CE. Conformément au EU MDR 2017/745 EU MDR , les exigences relatives à un Clinical Evaluation Report (CER), y compris les exigences en matière de processus et de données, varient en fonction de la classe d'un dispositif et sont nécessaires pour obtenir la certification CE des dispositifs médicaux. Les dispositifs de classe I à faible risque peuvent faire l'objet d'une autocertification CE. En revanche, les autres classes de dispositifs (IIa, IIb, III) doivent obtenir la certification CE par l'intermédiaire d'un organisme notifié (ON) accrédité. Le fabricant doit soumettre le dossier technique CE à l'ON pour évaluation, approbation du marquage CE et délivrance du certificat CE. Le Clinical Evaluation Report (CER) pour les dispositifs médicaux doit être soumis avec le dossier technique CE pour se conformer aux exigences du marquage CE.
Le Clinical Evaluation Report (CER) pour les dispositifs médicaux est l'un des rapports qui doit être soumis avec le dossier technique CE pour se conformer aux exigences du CER.
Qu'est-ce qu'un Clinical Evaluation Report (CER)?
La rédaction d'un rapport d'évaluation clinique comprend l'évaluation et l'analyse des données cliniques relatives à un dispositif médical afin de vérifier sa sécurité et ses performances cliniques. L'évaluation clinique des dispositifs médicaux repose sur l'analyse complète des données cliniques antérieures et postérieures à la mise sur le marché, en rapport avec l'utilisation prévue. Le rapport d'évaluation clinique comprend les données spécifiques au dispositif, ainsi que toutes les données relatives aux dispositifs revendiqués comme équivalents par le fabricant.
Un rapport d'évaluation clinique se compose de littérature scientifique et de données cliniques analysées qui ont été recueillies soit à partir d'une étude clinique de votre dispositif, soit à partir des résultats d'autres études portant sur des dispositifs substantiellement équivalents. Le rapport d'évaluation clinique d'un dispositif médical démontre que le dispositif remplit la fonction pour laquelle il a été conçu sans exposer les utilisateurs et les patients à des risques supplémentaires.
Le rapport d'évaluation de l'EU MDR doit être mis à jour tous les ans. Si le dispositif est commercialisé depuis longtemps et qu'il est établi qu'il est sûr et ne présente pas de risque significatif, le rapport d'évaluation des risques peut être mis à jour tous les 2 à 5 ans. Toute modification apportée à la conception du dispositif et toute nouvelle information provenant des données PMS peuvent entraîner une mise à jour du rapport CER.
L'évaluation clinique des dispositifs médicaux, telle qu'elle est encadrée par le Clinical Evaluation Report (CER), repose sur les facteurs énumérés ci-dessous.
- Littérature scientifique actuellement disponible ; et/ou
- les investigations cliniques effectuées ; ou
- Si la démonstration de la conformité aux exigences essentielles sur la base de données cliniques n'est pas jugée appropriée.
Étapes de la rédaction d'un Clinical Evaluation Report (CER)
Conformément au nouveau règlement européen sur les dispositifs médicaux (MDR) - 2017/745, l'évaluation clinique des dispositifs médicaux comporte quatre (04) étapes différentes afin de préparer un Clinical Evaluation Report (CER) MDR européen complet.
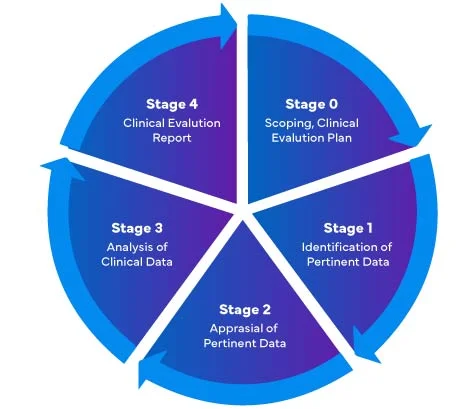
Les fabricants de dispositifs médicaux qui entrent pour la première fois sur le marché européen doivent s'assurer que leur rapport d'évaluation clinique est conforme à la réglementation EU MDR
Freyr des services end-to-end de certification end-to-end aux fabricants d'appareils, y compris la rédaction de rapports d'évaluation clinique conformément à la nouvelle réglementation EU MDR . Fort d'une solide expertise régionale en matière de dispositifs médicaux dans l'UE, Freyr aux exigences des agences et personnalise le rapport d'évaluation clinique en conséquence.
Clinical evaluation report (CER)
- Assistance à la rédaction du rapport d'évaluation End-to-end , y compris la recherche documentaire, conformément à la norme MEDDEV 2.7/1 révision 4 et aux lignes directrices du règlement européen sur les dispositifs médicaux (MDR).
- Élaborer un plan d'évaluation clinique pour votre organisation.
- Identifier, rechercher, analyser et rassembler la littérature scientifique appropriée applicable.
- Élaborer un modèle de rapport d'évaluation clinique pour votre organisation.
- Analyse des lacunes du rapport d'évaluation clinique existant.
- Outil DMS permettant à votre équipe de contribuer collectivement à la rédaction du rapport d'évaluation clinique.
- Intégration des données PMS.
- Élaborer une procédure opérationnelle standard pour que votre équipe compile les données PMS afin de mettre à jour les rapports d'évaluation clinique.
- Traiter les mises à jour périodiques des rapports d'évaluation clinique existants, conformément aux lignes directrices MDR de l'UE.
- Prise en charge des données PMS pour les appareils existants sur le marché.
- Conformité au marquage CE et services de marquage CE.

- Assurer la conformité avec les récentes réglementations applicables.
- Équipe d'experts cliniques qualifiés.
- Contributions interfonctionnelles d'experts en dispositifs médicaux pour se conformer aux exigences.
- Service complet de conformité, d'examen et de planification.





