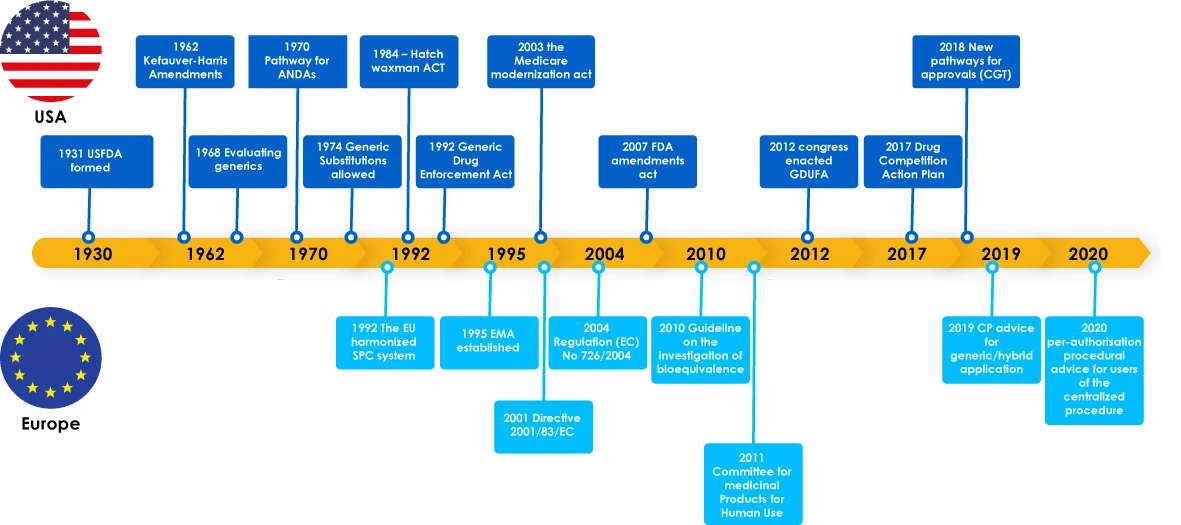
Évolution des produits génériques - Vue d'ensemble
Les médicaments génériques ont connu des étapes importantes, notamment des lois réglementaires visant à soutenir le développement des génériques, qui ont encouragé les fabricants à explorer le marché des génériques. Ces législations ont également donné aux médecins la confiance nécessaire pour prescrire un substitut à un médicament de marque, ce qui a finalement profité aux patients, car les fabricants de génériques ont répondu aux besoins critiques des patients dans le monde entier.
FAQ sur les génériques
Q1 : Qu'est-ce qu'un médicament générique ?
Réponse : Les médicaments génériques sont des médicaments pharmaceutiques qui sont des copies identiques du médicament d'origine et qui ont le même principe actif, la même posologie, la même utilisation prévue, les mêmes effets secondaires, la même voie d'administration, les mêmes risques, la même sécurité et le même dosage que le médicament d'origine, mais ils peuvent différer par certaines caractéristiques telles que le processus de fabrication, la formulation, les excipients, la couleur, le goût et l'emballage. En d'autres termes, un médicament générique est thérapeutiquement équivalent à un médicament de marque et peut donc être remplacé par son équivalent de marque.
Q2 : Pourquoi les médicaments génériques coûtent-ils moins cher que les médicaments innovants ?
Réponse : Les médicaments génériques sont plus rentables que les médicaments innovants, car ils ne doivent pas répéter les longues et coûteuses études précliniques et cliniques requises pour les médicaments innovants afin de démontrer leur sécurité et leur efficacité ; au lieu de cela, les médicaments génériques ne doivent prouver que l'équivalence pharmaceutique de leur produit.
Q3 : Les médicaments génériques sont-ils aussi efficaces que les médicaments innovants ?
Réponse : Oui, les médicaments génériques ont la même qualité, la même efficacité et sont aussi sûrs que les médicaments de marque. Le prix inférieur de ces médicaments ne signifie pas qu'ils sont de qualité inférieure, car les médicaments génériques, tout comme les médicaments d'origine, doivent passer par un processus d'approbation rigoureux pour pouvoir être commercialisés. Les entreprises pharmaceutiques sont tenues de soumettre une demande d'autorisation de médicament générique démontrant que leur produit présente les mêmes avantages cliniques que les médicaments d'origine et qu'il peut être utilisé comme substitut de leur médicament d'origine respectif.
Q4 : Pourquoi les médicaments génériques ont-ils un aspect différent de celui des médicaments de marque ?
Réponse : les médicaments génériques doivent être bioéquivalents aux médicaments de marque et avoir le même principe actif que les médicaments innovants. Toutefois, les médicaments génériques peuvent présenter des différences minimes en ce qui concerne la forme, l'étiquetage (différences mineures), l'emballage et les ingrédients inactifs tels que les colorants, les arômes et les conservateurs, mais l'efficacité du médicament doit rester la même.
Q5 : En quoi consistent l'examen et l'approbation des demandes d'autorisation de mise sur le marché de médicaments génériques aux US?
Réponse : Toute société pharmaceutique qui commercialise ses médicaments génériques aux US se conformer à toutes les exigences réglementairesFDA US en matière d'enregistrement des médicaments génériques et doit démontrer que :
- Le médicament générique est "pharmaceutiquement/thérapeutiquement équivalent" à la marque.
- Le fabricant est capable de produire le médicament de manière correcte et constante.
- Le "principe actif" est le même que celui de la marque.
- La bonne quantité de l'ingrédient actif arrive à l'endroit du corps où il a un effet.
- Les ingrédients "inactifs" du médicament sont sûrs.
- Le médicament ne se dégrade pas avec le temps
- Le récipient dans lequel le médicament sera expédié et vendu est approprié.
- L'étiquette est la même que celle du médicament d'origine.
- Les brevets pertinents ou les exclusivités légales ont expiré.
Q6 : Chaque médicament de marque a-t-il un générique ?
Réponse : Non. Il n'existe pas de version générique de tous les médicaments de marque. Les nouveaux médicaments sont fabriqués sous la protection d'un brevet pour une durée maximale de vingt (20) ans. Cela signifie qu'aucun autre médicament ne peut être fabriqué et commercialisé pendant cette période, jusqu'à l'expiration du brevet. Toutefois, certains médicaments peuvent ne jamais avoir de version générique de leur produit, en raison de difficultés de fabrication ou parce que le produit générique peut être jugé non rentable.




