Aperçu des services de mise en conformité avec le EU MDR
Le règlement de l'UE sur les dispositifs médicaux (MDR) est entré en vigueur le 26 mai 2021, après un délai de transition de trois ans et une prolongation d'un an en raison de la pandémie de COVID-19. Les dispositifs lancés sur le marché de l'UE doivent désormais être conformes à ce règlement et doivent être certifiés CE conformément au EU MDR par les organismes notifiés accrédités en vertu de ce règlement. Les dispositifs qui ont déjà été certifiés CE conformément à la directive européenne sur les dispositifs médicaux bénéficient toutefois d'un délai de grâce avant de devoir se conformer pleinement aux exigences de EU MDR . Pendant cette période de grâce, les dispositifs certifiés à la fois selon la directive européenne sur les dispositifs médicaux et EU MDR dispositifs médicaux co sur le marché avec le même statut et sans faire l'objet de discrimination. Freyr offre des services inégalés de mise en conformité avec le EU MDR 'EU MDR afin d'aider les entreprises de dispositifs médicaux à répondre aux exigences EU MDR dans les délais impartis.
Calendrier de transition et nouvelles classifications des dispositifs
Le European Medical Device Regulation (MDR) entrera pleinement en vigueur dans tous les member states 'UE et les États de l'Association européenne de libre-échange (AELE) à partir de mai 2021 et offre aux fabricants une période de transition de quatre ans pour obtenir la certification MDR de l'UE.
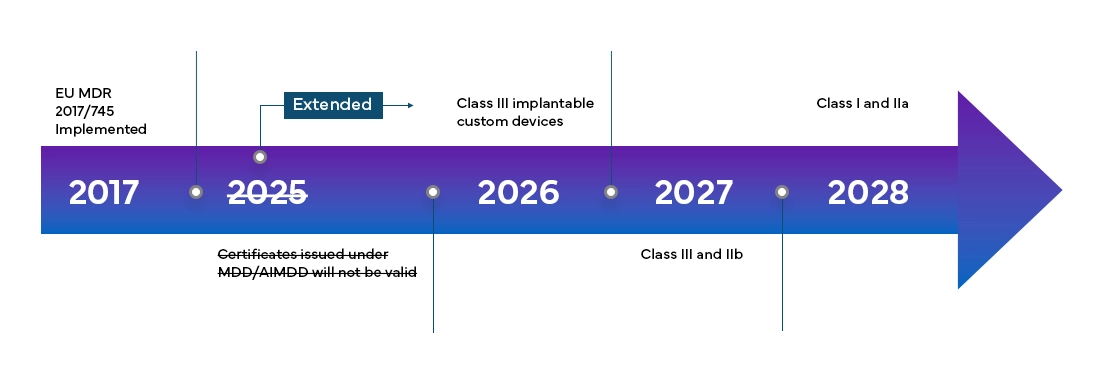
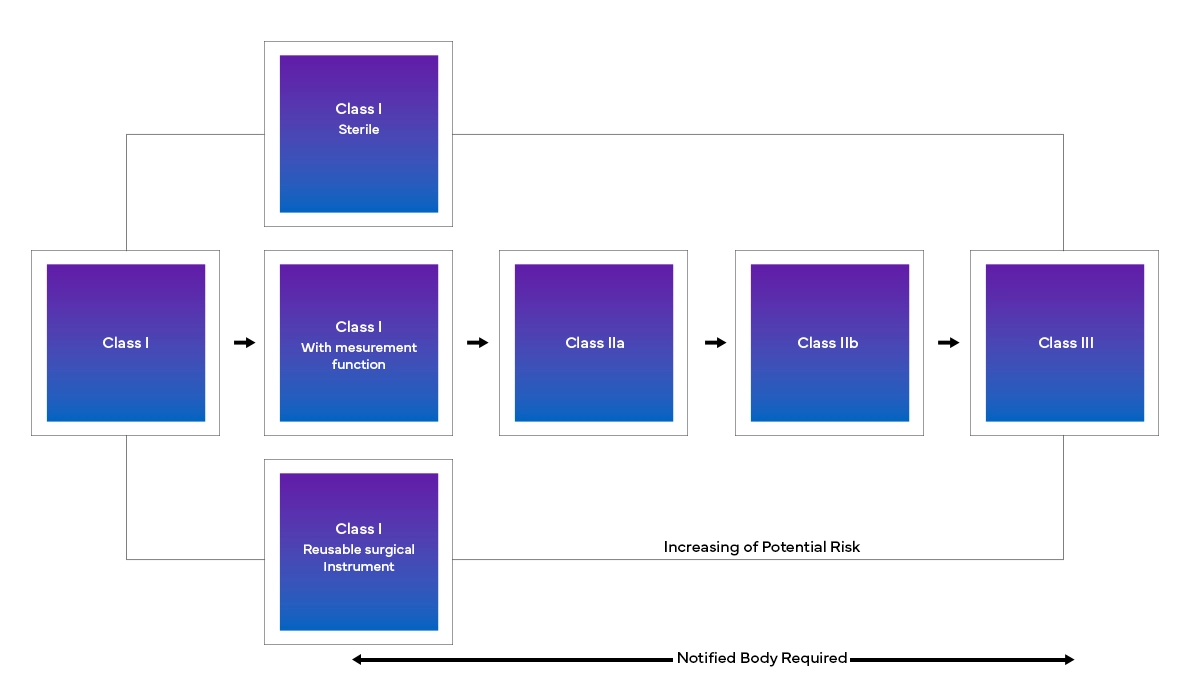
Le nouveau European Medical Device Regulation (MDR), tel qu'il a été observé, a également apporté des modifications au système de classification des dispositifs existant, notamment :
De l'identification des changements exacts à apporter à leur mise en œuvre en temps réel, les fabricants peuvent être amenés à relever toute une série de défis pour se conformer aux exigences du règlement européen sur les dispositifs médicaux. Qu'il s'agisse de décoder la nouvelle structure, de classer un dispositif avec précision, de rassembler et de soumettre toutes les données, les fabricants devront adopter une approche réglementaire plus détaillée et plus transversale pour se conformer à la nouvelle réglementation européenne sur les dispositifs médicaux. Grâce à une analyse rigoureuse des lacunes, Freyr assiste ses clients dans l'établissement du statu quo et fournit les mesures réglementaires nécessaires à la transition et à la mise en conformité avec le règlement européen sur les dispositifs médicaux (EU MDR).
Obtenez des conseils d'experts sur votre conformité au EU MDR
Services de mise en conformité avec le EU MDR
- Développer une stratégie claire de mise en œuvre du règlement sur les dispositifs médicaux (MDR)
- Comprendre la nouvelle législation, effectuer une analyse des écarts par rapport aux systèmes de gestion de la qualité (SGQ) actuels et aux processus en place.
- Élaboration d'un plan détaillé avec une approche interfonctionnelle pour déterminer les aspects du système de qualité qui devront être modifiés conformément au nouveau règlement de l'UE sur les dispositifs médicaux.
- Former plusieurs équipes pour analyser le champ d'application du produit, la classification, le traitement du système de gestion de la qualité, etc. au sein de l'organisation, avec un point de contact unique dans chaque équipe.
- Allocation et planification des ressources
- Prendre en compte l'interaction de votre système de gestion de la qualité avec d'autres réglementations et utiliser cette opportunité pour rationaliser les processus, tout en laissant la possibilité d'intégrer des changements futurs.
- Analyser les données de test en place et vérifier toute exigence supplémentaire mise en place par le MDR.
- Coordonner les attentes et le plan de transition avec les organismes notifiés de l'UE
- Analyse de l'écart entre les dispositifs médicaux existants et les règlements MDD et EU MDR
- End-to-end pour l'élaboration Clinical Evaluation Report (CER), y compris la recherche documentaire conformément aux lignes directrices European Medical Device Regulation EU MDR).
- End-to-end pour les rapports de surveillance post-commercialisation (PMSR), les rapports périodiques de sécurité (PSUR) et les résumés de sécurité et de performance clinique (SSCP)
- Augmentation des ressources réglementaires avec des options de déploiement à terre et en mer
- Services du représentant autorisé européen (EAR)
- Conformité au règlement MDR et aide à la soumission aux organismes notifiés
- Veille réglementaire couvrant le processus d'importation des différents marchés réglementés
- Conformité du système de gestion de la qualité et audits fictifs
- Système de gestion des documents et outil pour les entreprises MDR
- Classification et reclassification des dispositifs en fonction du risque
- Mise en œuvre de l'UDI et conseils
- Services de surveillance post-commercialisation conformes au règlement de l'UE sur les dispositifs médicaux
- Gestion des risques Conseil ISO 14971
- Formation interne et en ligne
- Personne responsable des services et de l'assistance en matière de conformité réglementaire
- Identification des organismes notifiés MDR

Pour bénéficier d'une assistance end-to-end concernant EU MDR, reach Freyr.




