Vue d'ensemble des services de mise en conformité avec l'IVDR de l'UE
Le règlement européen sur le diagnostic in vitro (EU IVDR) constitue une nouvelle base réglementaire pour la mise sur le marché européen des dispositifs médicaux de diagnostic in vitro. Ce règlement est destiné à remplacer la directive actuelle de l'UE sur les dispositifs médicaux de diagnostic in vitro (UE 98/79/CE). En tant que règlement européen, il sera effectif dans tous les Member States l'UE et dans les États de l'Association européenne de libre-échange (AELE), sans qu'il soit nécessaire de le transposer dans la législation des États respectifs. En tant que partenaire réglementaire éprouvé, Freyr propose aux fabricants des services de mise en conformité avec l'IVDR de l'UE et des services de conseil en matière d'IVDR pour la mise en conformité avec les règlements sur le diagnostic in vitro et le marquage CE.
Prenez rendez-vous avec nos experts en matière de droits de l'homme dans l'UE
Le règlement IVDR - Calendrier de transition
Le nouvel IVDR de l'UE, qui doit entrer en vigueur le 26 mai 2022, est considéré comme un changement important dans la surveillance réglementaire des DIV. L'aperçu de la transition vers l'IVDR est présenté ci-dessous -
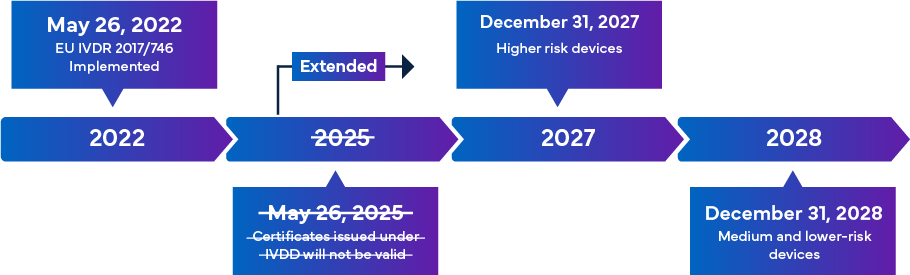
Une fois pleinement mises en œuvre, les règles de conformité de l'IVDR garantissent que presque tous les DIV entrant sur le marché européen sont soumis à l'examen de l'organisme notifié (ON) de l'IVDR et à la certification du marquage CE dans le cadre de la procédure d'approbation des DIV. Dans ce scénario, outre l'alignement sur la classification actualisée de l'IVDR, les fabricants doivent immédiatement revoir la documentation technique clé pour réussir l'enregistrement de l'IVD et le marquage CE. Les exigences de l'IVDR varient en fonction de la classe de risque du DIV. En général, pour la certification d'un DIV, les fabricants doivent effectuer ce qui suit :
- Examens des dossiers techniques conformément au règlement IVDR (règlement UE 2017/746)
- Préparation du rapport d'évaluation des performances (PER) pour tous les DIV
- Suivi des performances après la mise sur le marché (PMPF) conformément à l'annexe XIII, partie B, de la directive sur les médicaments vétérinaires.
- Rapport de vigilance conformément à l'article 82 de l'IVDR
Freyr aide ses clients à effectuer une revue systématique de la littérature scientifique et les assiste dans la planification et la préparation d'une PER pour la conformité à la réglementation sur les dispositifs médicaux de diagnostic in vitro. Freyr dispose d'experts spécialisés qui fournissent des services de conseil en matière d'IVDR et Post-market Surveillance (PMS) , qui fait partie intégrante du système de gestion de la qualité du fabricant, au même titre que le suivi des performances post-commercialisation (PMPF).
Obtenez des conseils d'experts sur votre conformité à l'IVDR de l'UE
Expertise et avantages des services de mise en conformité avec l'IVDR de l'UE
- Plan de transition pour la mise en conformité avec l'IVDR
- Examen technique et analyse des lacunes des exigences de l'IVDR pour les GSPR (exigences générales de sécurité et de performance)
- Soutenir la compilation du dossier technique conformément aux exigences de l'IVDR
- Rapports de validité scientifique basés sur la littérature et/ou les données internes
- Rapports sur les performances cliniques basés sur la littérature et/ou les données internes
- Preuves cliniques ou rapports d'évaluation des performances
- Protocoles et rapports de suivi des performances après la mise sur le marché (PMPF)
- Post-market Surveillance (PMS) et rapports Post-market Surveillance (PMS)
- Rédiger/réviser d'autres documents tels que les notices d'emballage/IFU (instructions d'utilisation), les instructions de référence rapide (QRI), le manuel d'utilisation/de fonctionnement, etc.

- Conformité au règlement sur les dispositifs médicaux de diagnostic in vitro, enregistrement des dispositifs médicaux de diagnostic in vitro et marquage CE garantis
- Forte compréhension de la réglementation et expertise dans les domaines d'impact clés de l'IVDR de l'UE
- Modèle de livraison axé sur la gestion de projet afin d'assurer le respect du calendrier.
- Experts internes de l'ON (examen du rapport par les examinateurs interactifs de l'ON)
- Équipes spécialisées disposant d'une expertise croisée dans des domaines d'impact et des catégories de dispositifs spécifiques
- Contributions interfonctionnelles d'experts en dispositifs médicaux pour se conformer aux exigences.
- Gamme complète de services en matière de conformité, d'examen et de planification
- Forte expertise dans le maintien de la cohérence des livrables (temps et qualité)





