Services d'étiquetage clinique - Vue d'ensemble
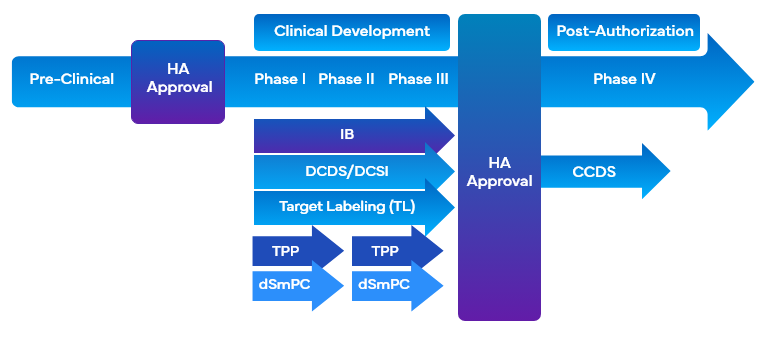
Au cours du développement d'un médicament, les entreprises utilisent une variété d'outils liés à l'étiquetage clinique qui utilisent l'étiquetage ciblé pour faciliter le développement du médicament. Ces outils permettent d'aligner simultanément les objectifs de commercialisation et d'étiquetage des essais cliniques avec la conception du programme de développement ou la conception de l'étude et facilitent la rédaction de l'aperçu cliniqueCO. Voici quelques-uns des outils d'étiquetage clinique qui utilisent l'étiquetage ciblé pendant le développement d'un médicament :
- Brochure du chercheurIB
- Marquage de la cibleTL)/Profil de la cible
- Fiche technique du noyau de développementDCDS
- Développement d'informations de base sur la sécuritéDCSI
- Profil de produit cible de FDA TPP
Il est important que les entreprises adoptent une approche modulaire tout en recueillant les informations relatives à la sécurité et à l'efficacité sur plusieurs types d'étiquettes cliniques afin de compléter les exigences en matière d'étiquetage clinique. Cela répondrait à la nécessité d'aider efficacement les chercheurs et les promoteurs en présentant et en mettant à jour une section DCSI ciblée et dédiée qui peut être commodément placée dans différentes catégories cliniques.
En outre, la DCSI est incluse dans les informations de sécurité de base de l'entrepriseCCSI, qui constituent la base de la première fiche de données de base de l'entrepriseCCDS et qui sont utilisées pour l'entrée du produit sur le marché. Il est également nécessaire de rédiger un CO très complet, comprenant la portée et les points critiques du programme de développement clinique du médicament, afin d'étayer la documentation destinée aux évaluateurs.
Services d'étiquetage clinique de Freyr
Services d'étiquetage clinique
- Création et révision de la brochure d'investigationIB
Freyr possède une grande expertise dans la création, la rédaction et la révision des notices d'information pour divers programmes cliniques de nos clients. Les notices d'information sont les formes les plus récentes d'étiquettes destinées à fournir à l'investigateur ou au médecin traitant des informations pertinentes sur le médicament ou l'intervention. Leur objectif est de fournir aux investigateurs et aux autres personnes impliquées dans l'essai les informations nécessaires pour faciliter leur compréhension de la raison d'être de nombreuses caractéristiques clés du protocole et leur respect de celles-ci. Il s'agit notamment de la dose, de la fréquence et de l'intervalle des doses, des méthodes d'administration et des procédures de surveillance de la sécurité. L'IB contient des informations précliniques et cliniques relatives à un médicament expérimental.

Lorsqu'ils travaillent sur les IB, les experts en étiquetage clinique de Freyrprésentent les informations sous une forme concise, simple, objective et équilibrée. Les mêmes qualités peuvent être prises en compte lors de la traduction des documents. Outre la rédaction des IB, Freyr prend également en charge la révision annuelle des IB et travaille sur les révisions nécessaires, conformément aux procédures standard établies par les clients et les sponsors.
- Développement du marquage de la cibleTL)/profil de la cible
- Développement et révision des DCDS et DCSI
Freyr a démontré son expertise dans la création de Developmental Core Data SheetsDCDS de haute qualité. La DCDS est une étiquette intermédiaire essentielle pour dériver le contenu des étiquettes nationales de premier niveau (comme USPI, SmPC, etc.). La DCSI est préparée à partir de l'étiquette cible et fournit des informations intégrées sur la sécurité et l'efficacité d'une intervention ou d'un médicament. Le DCSI aide les investigateurs et les sponsors en présentant et en mettant à jour des sections DCDS ciblées et dédiées qui peuvent être facilement placées dans l'IB La DCSI facilite le développement de la CCSI, qui fait ensuite partie intégrante de la fiche de données de base de l'entrepriseCCDS.
- Élaboration et examen du profil de produit cible de FDA TPP et du projet de SmPC de l'UE (dSmPC)
Le profil du produit cible (TPP) / le résumé provisoire des caractéristiques du produit (dSmPC) est une forme d'étiquette clinique qui facilite les discussions entre les sociétés pharmaceutiques et les autorités sanitaires. Le TPP est utilisé tout au long du processus de développement d'un médicament, depuis les phases de demande préalable à l'autorisation de mise sur le marché (IND) et de demande d'autorisation de mise sur le marché (IND) jusqu'aux programmes post-commercialisation, afin de rechercher de nouvelles indications ou d'autres modifications substantielles dans l'étiquetage des essais cliniques. Les sociétés pharmaceutiques précisent les concepts d'étiquetage qui constituent les objectifs du programme de développement du médicament sous la forme d'TPP. TPP fournit une déclaration de l'intention globale du programme de développement du médicament et donne des informations sur le médicament à un stade particulier de son développement. En tant que partenaire stratégique en matière de réglementation, Freyr possède une expertise dans la préparation de TPP pour les US de dSmPC pour l'UE.
- Ressources possédant des connaissances réglementaires approfondies en matière d'emballage et d'étiquetage cliniques
- Expertise dans la gestion réussie de l'étiquetage des médicaments au niveau mondial et régional pour des clients pharmaceutiques de Fortune aux États-Unis, en Europe, dans la région APAC, dans la région MENA, etc.
- Expertise réglementaire globale pour aider les organisations des sciences de la vie, c'est-à-dire les fabricants de produits pharmaceutiques, biotechnologiques et nutritionnels.
- Rédacteurs médicaux hautement qualifiés possédant une vaste expérience en matière d'étiquetage réglementaire
- Compréhension approfondie et actualisée des modifications apportées à l'étiquetage des médicaments au niveau mondial par de multiples autorités sanitaires telles que l USFDA, l'EMA, la TGA, etc.
- Une équipe dédiée à la conformité suit l'état d'avancement de la mise en œuvre des fiches de données de base et des fiches de données de base de l'entrepriseCDSCCDSCDS dans les labels régionaux.
- Expertise en matière d'étiquetage des essais cliniques et de services d'étiquetage clinique
- Des professionnels de l'étiquetage pharmaceutique, biotechnologique et nutritionnel très expérimentés





