
Salutations de
Freyr Nouvelle-Zélande
Avec un secteur pharmaceutique et médical en pleine croissance, la Nouvelle-Zélande semble être un pari potentiel pour les fabricants du monde entier qui souhaitent commercialiser leurs Produits médicaux leurs dispositifs dans la région. Pour ce faire, les fabricants doivent se conformer à l'autorité réglementaire de la région, la New Zealand Medicines and Medical Device Safety Authority (MedSafe), et, pour les dispositifs médicaux, ils doivent enregistrer leurs produits dans le Web Assisted Notification of Devices (WAND), au plus tard 30 jours après l'exportation. Bien que les fabricants ne soient pas tenus d'obtenir des autorisations préalables à la mise sur le marché pour entrer dans la région, les modifications législatives proposées et la volonté du gouvernement néo-zélandais de réformer son système réglementaire actuel pourraient dissuader les nouveaux entrants sur le marché en raison du manque de clarté des exigences réglementaires.
En tant que partenaire réglementaire mondial spécialisé, Freyr aide les fabricants étrangers à se tenir informés des dernières exigences réglementaires dans la région et fournit des services end-to-end en Nouvelle-Zélande, notamment dans les domaines suivants :
Industries que nous servons en Nouvelle-Zélande

Grâce à son économie prospère, la Nouvelle-Zélande est considérée comme un marché florissant pour les produits pharmaceutiques. Les fabricants souhaitant distribuer et commercialiser leurs Produits médicaux Nouvelle-Zélande doivent obtenir l'autorisation de l'autorité néo-zélandaise chargée de la sécurité des médicaments et des dispositifs médicaux, MEDSAFE. La réglementation générale applicable Produits médicaux s'avérer difficile à décrypter pour les nouveaux entrants sur le marché, et l'aide d'un expert en matière de réglementation peut être nécessaire pour élaborer une stratégie commerciale.
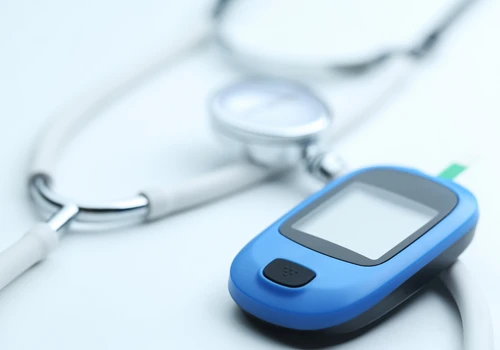
En Nouvelle-Zélande, les dispositifs médicaux sont réglementés par la New Zealand Medicines and Medical Devices Safety Authority (Medsafe) conformément aux Medicines Regulations 1984, à la Medicines Act 1981 et aux Medicines (Database of Medical Devices) Regulations 2003. Bien que l'approbation préalable à la mise sur le marché ne soit pas nécessaire, l'inscription des produits dans la base de données du système WAND (Electronic Web Assisted Notification of Devices) dans les 30 jours suivant le lancement commercial est indispensable. Medsafe peut demander des documents prouvant la sécurité et l'efficacité des produits, tels que la certification d'organismes reconnus comme un organisme notifié de l'UE ou de Health Canada.

En Nouvelle-Zélande, les produits cosmétiques sont réglementés par l'Environmental Protection AuthorityEPA. L'importation et la fabrication de produits cosmétiques dans le pays exigent que les fabricants respectent les conditions fixées par l'Environmental Protection AuthorityEPA) New Zealand dans le cadre du Cosmetic Products Group Standard. L'entrée sur le marché néo-zélandais peut s'avérer difficile pour les fabricants de cosmétiques en raison d'une connaissance limitée de la réglementation en matière de cosmétiques et des tendances actuelles du marché.

Le marché néo-zélandais des produits alimentaires et des compléments alimentaires est un marché établi mais dynamique, dont la principale stratégie de croissance est la différenciation des produits... Food Standards Australia New Zealand (FSANZ) est l'organisme statutaire du portefeuille de la santé du gouvernement néo-zélandais, qui élabore les normes alimentaires pour l'Australie et la Nouvelle-Zélande. Cependant, les compléments alimentaires sont réglementés par le Dietary Supplements Regulations, 1985, qui relève du Ministry for Primary Industries (MPI) Food Act, 2014. Medsafe est responsable de l'application de la réglementation sur les compléments alimentaires et de la loi sur l'alimentation.
Offres de Freyr
- Conseil stratégique en matière de réglementation
- Feuille de route réglementaire pour l'accès au marché
- Affaires réglementaires et intelligence réglementaire
- Chemins d'enregistrement et services de gestion des licences
- Demandes d'autorisation de mise sur le marché,
- Préparation et soumission des demandes de nouveaux médicaments
- Gestion et maintien de la procédure de notification
- Formation sur site à la base de données WAND (Web Assisted Notification of Devices)
- End-to-end dans le cadre d'enquêtes sur les événements indésirables liés aux dispositifs médicaux
- Bonnes pratiques de fabrication (BPF) et GLP
- Étiquetage des produits et soutien à la publicité
- CMC NDA, ANDA, CTD, gestion des changements post-approbation - SUPAC
- Soumissions réglementaires et suivi
- la manipulation et la maintenance, y compris la documentation électronique21 CFR part 11
- Préparation des SPC, des notices d'emballage, de la justification des produits,
- Préparation des rapports PSUR
- Compilation DMF
- Rédaction médicale
- Activités post-commercialisation, Maintenance post-commercialisation
Avantages de Freyr
- Contacts stratégiques des autorités sanitaires locales - avec Medsafe
- Une équipe d'experts en réglementation, forte de plus de 25 ans d'expérience et d'une expertise mondiale avérée en matière RA
- Approche proactive et collaborative
- Des délais d'exécution rapides et une mise sur le marché plus rapide
- Se tenir au courant de la législation spécifique à la région et des lignes directrices réglementaires
