
Aperçu de l'enregistrement des dispositifs médicaux en Europe
L'UE, composée de 27 member states a élaboré le règlement sur les dispositifs médicaux (MDR) 2017/745 et le règlement sur les dispositifs médicaux de diagnostic in vitro (IVDR) 2017/746, qui ont été entièrement mis en œuvre récemment. Ces règlements font partie intégrante du processus d'enregistrement des dispositifs médicaux en Europe et remplacent désormais les directives. Les deux règlements comportent de nouvelles exigences supplémentaires, et il s'agit des procédures réglementaires centralisées qui devront être suivies pour placer les dispositifs médicaux dans l'un des 27 pays. Les fabricants étrangers de dispositifs médicaux who n'ont pas d'établissement physique en Europe doivent désigner un représentant autorisé européen (EAR) pour les aider à se conformer à ces réglementations.
Autorité de régulation : Autorité nationale compétente
Règlement : Règlement sur les dispositifs médicaux (MDR) 2017/745, Règlement sur les dispositifs de diagnostic in vitro 2017/746
Voie réglementaire : Marquage CE suivi d'un enregistrement/notification
Représentant autorisé : Représentant autorisé européen (EAR) pour les fabricants de pays tiers
Exigence du SMQ : ISO 13485:2016
Évaluation des données techniques : Organisme notifié pour le marquage CE
Classification des dispositifs
La classification du dispositif est la toute première étape dans la détermination de la voie réglementaire pour un produit donné. Il existe environ 22 règles d'application pour les dispositifs médicaux, qui sont classées comme suit : - les règles d'application pour les dispositifs médicaux sont classées comme suit
| Classe | Risque |
|---|---|
| Classe I | Faible |
| Classe IIa | Modéré |
| Classe IIb | Modéré à élevé |
| Classe III | Haut |
De même, pour les DIV, environ 7 règles sont mises en œuvre pour classer les produits dans les quatre catégories suivantes
| Classe | Risque |
|---|---|
| Classe A | Faible |
| Classe B | Modéré |
| Classe C | Modéré à élevé |
| Classe D | Haut |
Compte tenu des instructions spécialisées en vigueur pour les différentes classes, l'identification de la bonne classe de dispositifs est cruciale pour déterminer la voie réglementaire.
Représentant autorisé européen (EAR)
Tout fabricant étranger ayant l'intention de lancer ses dispositifs dans la région de l'UE est tenu de nommer un représentant autorisé européen (EAR) conformément à l'article 11 du EU MDR et du RIVD de EU MDR
Enregistrement des dispositifs médicaux
L'obtention du marquage CE est obligatoire pour commercialiser les dispositifs médicaux dans l'UE. Les fabricants sont tenus d'identifier et de nommer les personnes notifiées, de procéder à l'évaluation de la conformité et de délivrer la certification CE.
Décoder les informations réglementaires relatives à l'enregistrement ou à la notification d'un dispositif via un système d'enregistrement en ligne peut s'avérer difficile sans l'aide d'un expert.
Déroulement du processus
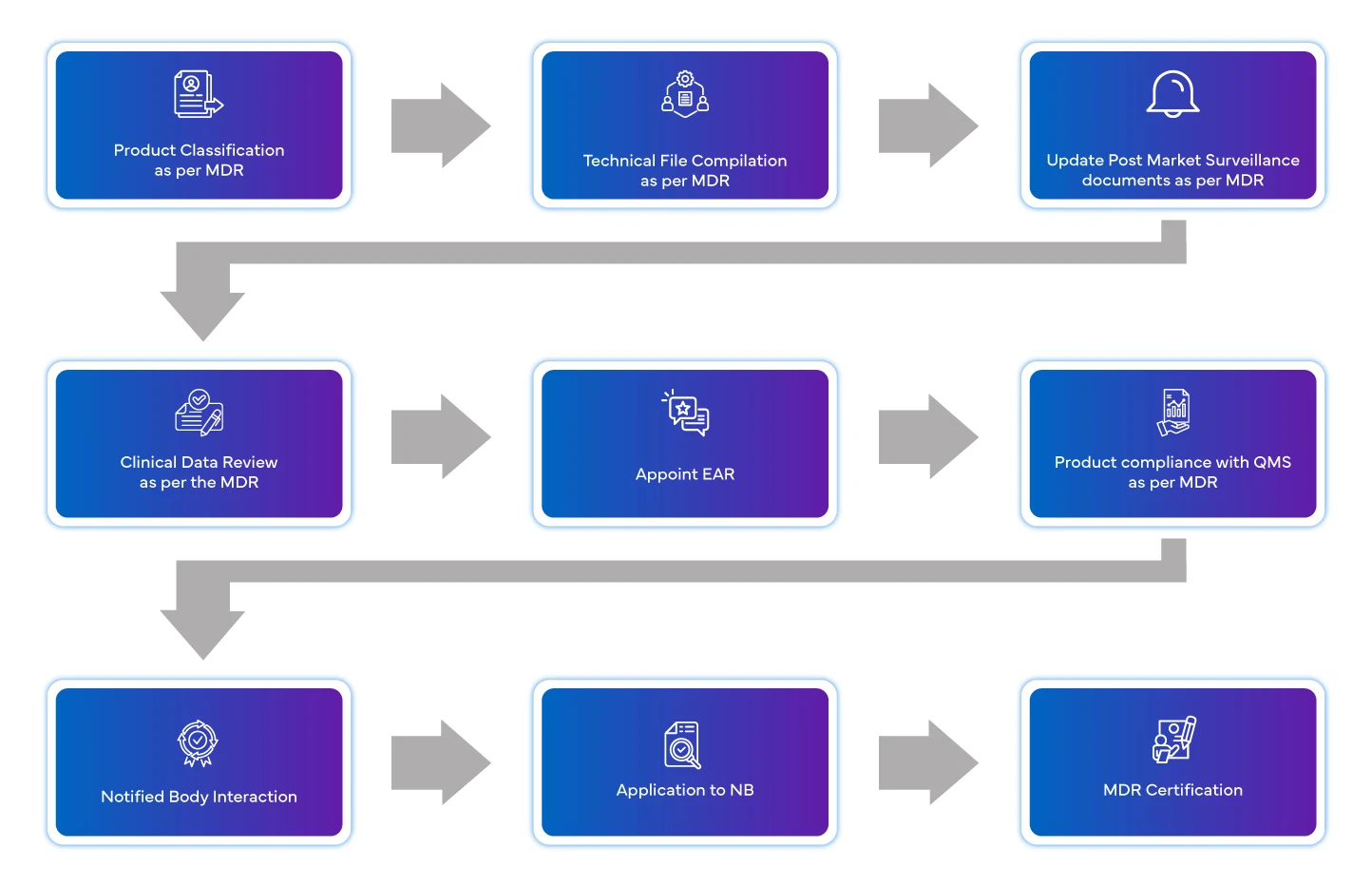
Gestion du cycle de vie des appareils après leur homologation
La réglementation européenne sur les dispositifs médicaux met désormais l'accent sur l'importance des exigences post-commercialisation. Le fabricant doit être équipé d'un système de gestion de la surveillance. Une information périodique doit être fournie pour le dispositif.
Freyr peut vous aider à élaborer post-market surveillance (PMS) , un rapport de surveillance post-commercialisation (PMSR), un rapport périodique de sécurité (PSUR) et un suivi clinique post-commercialisation (PMCF)/suivi des performances post-commercialisation (PMPF).
Le soutien de Freyr comprend également des activités telles que -
- Gestion des modifications après approbation - modifications des approbations de dispositifs médicaux existants, telles que l'ajout de nouvelles variantes, d'accessoires, l'ajout de nouvelles indications d'utilisation, etc.
- Maintien de la certification ISO 13485:2016 et CE
- Renouvellement des licences
- Liaison entre l'organisme notifié et le fabricant
Enregistrement des dispositifs médicaux en Europe
Expertise Freyr
- Classification européenne des dispositifs médicaux
- Soutien du représentant autorisé européen (EAR)
- ISO 14971:2019 Consultation sur la gestion des risques
- Conformité à la ISO 13485:2016
- Examen, compilation et soumission du dossier technique/de conception CE
- Soutien à la transition des EU MDR
- Soutien à la transition vers l'IVDR de l'UE
- Clinical Evaluation Reports (CER) pour les dispositifs médicaux
- Rapports d'évaluation des performances (PER) pour les dispositifs de diagnostic in vitro
- Notification/enregistrement des dispositifs médicaux via le système d'enregistrement en ligne
- Rapport sur la stratégie de réglementation des dispositifs médicaux
- Support d'essai - biocompatibilité, sécurité électrique, mécanique et performance
- Conformité du labelling
- Soutien aux BPF
- Soutien à la surveillance après la mise sur le marché

