Aperçu du programme eSTAR de FDA
L'initiative eSTAR de FDA a été formulée pour améliorer l'efficacité et l'uniformité de la préparation et de l'évaluation des demandes 510(k) et De Novo de FDA . Issu de l'approche initiale eSubmitter, qui impliquait la soumission électronique des dispositifs médicaux et des demandes de DIV, le programme eSTAR a été mis en place en s'appuyant sur l'expérience antérieure de la FDA. La FDA a lancé un programme différent appelé Electronic Submission Template and Resource (eSTAR) Pilot Program. À partir du 1er octobre 2023, les soumissions 510(k) (traditionnelles, abrégées ou spéciales) devront utiliser le programme eSTAR. Les modèles sont disponibles pour un accès en ligne, bien qu'ils nécessitent l'utilisation des identifiants de compte de FDA pour le processus de soumission proprement dit.
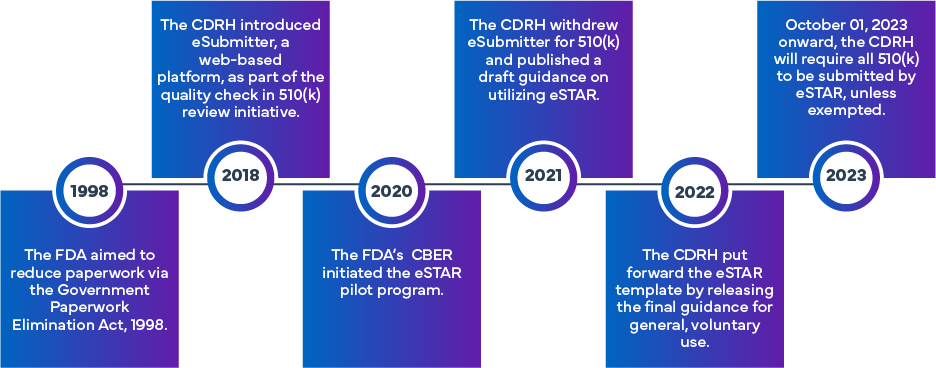
Qu'est-ce que le programme eSTAR de FDA ?
L'eSTAR est un modèle PDF interactif conçu pour faciliter la préparation d'une demande complète de mise sur le marché d'un dispositif médical dans le cadre du processus d'autorisation 510(k) FDAaux US. Les demandeurs peuvent également utiliser l'eSTAR pour répondre aux demandes d'informations supplémentaires FDA. Son objectif est d'améliorer la qualité des demandes pour divers dispositifs médicaux en garantissant que les demandeurs fournissent des données complètes et de haute qualité pour l'examen préalable à la mise sur le marché FDA.
En adoptant le format eSTAR, les demandeurs peuvent être sûrs que leurs demandes sont complètes, ce qui permettra à la FDA d'effectuer plus efficacement les examens préalables à la mise sur le marché et de garantir un accès rapide à des dispositifs médicaux sûrs et efficaces. Le modèle eSTAR est disponible gratuitement et peut être utilisé volontairement par tous les demandeurs de dispositifs médicaux pour les soumissions 510(k), De Novo et Q à la FDA. Il existe deux types de modèles eSTAR, l'un pour les dispositifs médicaux et l'autre pour les DIV. Le 9 juin 2023, la FDA a publié une version bêta d'eSTAR (PreSTAR) pour les pré-soumissions (un type de soumissions Q).
Caractéristiques et limites des soumissions eSTAR
Bien que le programme eSTAR propose un formulaire PDF interactif conçu pour aider les demandeurs à rédiger des demandes complètes de dispositifs médicaux et de DIV, il présente à la fois des avantages et des inconvénients. Les demandeurs doivent comprendre ces avantages et ces limites, afin de pouvoir choisir en toute connaissance de cause d'intégrer eSTAR dans leur processus de soumission. Dans le tableau ci-dessous, nous allons explorer les attributs et les restrictions du programme eSTAR.

Considérations pour une utilisation efficace d'eSTAR
Une caractéristique avantageuse du modèle eSTAR, qui contribue à l'optimisation du processus de soumission, est l'incorporation automatique des règlements pertinents et des normes reconnues à des fins de citation. Cela permet non seulement d'accélérer le processus de soumission en réduisant la saisie manuelle des données, mais aussi d'atténuer la possibilité d'erreurs humaines susceptibles de se produire lors de la saisie des règlements et des normes. Grâce à une construction guidée pour chaque section de la soumission, l'utilisation d'eSTAR dans le processus de soumission peut être rationalisée sans effort.
- La FDA propose Adobe Acrobat Pro ou Foxit PDF Editor pour l'édition des modèles eSTAR.
- eSTAR comprend certains formulaires intégrés, ce qui élimine la nécessité de les remplir séparément. Il s'agit du formulaire 3514 (page de couverture de la demande) et du formulaire 3881 (indications d'utilisation). En outre, la déclaration de véracité et d'exactitude, qui devait auparavant figurer sur le papier à en-tête de l'entreprise, est désormais intégrée dans eSTAR.
- eSTAR prend en charge divers formats de pièces jointes autres que les PDF, tels que les feuilles de calcul Excel et les fichiers vidéo (mp4).
- Les fichiers aux formats macro et exécutables ne sont pas autorisés.
- La taille totale du fichier PDF eSTAR et de ses pièces jointes ne doit pas dépasser 1 Go. Les fichiers de plus de 4 Go ne seront pas acceptés.
- Si vos fichiers électroniques dépassent les limites techniques, vous pouvez envoyer la soumission numérique au CDRH Document Control Center (DCC) par courrier.
Bonnes pratiques pour la préparation des candidatures eSTAR
Le respect de certaines des meilleures pratiques pour la préparation des soumissions eSTAR peut aider les candidats à rationaliser le processus de soumission et à améliorer leurs chances de réussite. Voici quelques bonnes pratiques :
- Respecter les directives de FDA : La FDA propose des lignes directrices pour aider les candidats à utiliser avec succès le modèle eSTAR. Le respect de ces lignes directrices garantit que les soumissions sont conformes aux exigences et aux attentes de la FDA.
- Assurer l'exhaustivité : Le modèle eSTAR guide les candidats à travers les informations essentielles à fournir. Les candidats doivent fournir tous les détails requis afin de minimiser les risques de lacunes ou de demandes d'informations supplémentaires.
- Maintenir la cohérence : Le modèle eSTAR favorise l'uniformité du contenu et de la structure des demandes 510(k). La construction guidée de chaque section de la soumission permet d'extraire des informations sur un dispositif médical.
- Privilégier la clarté : Fournir des détails clairs et concis dans les soumissions eSTAR pour faciliter un processus d'examen rationalisé. Ces détails et cette précision réduisent les retards et les erreurs, tout en garantissant un accès rapide aux demandes d'autorisation préalables à la mise sur le marché des dispositifs médicaux.
- Précision sécurisée : La vérification automatique des informations contenues dans chaque section des soumissions eSTAR permet de réduire les délais d'examen et les lacunes potentielles.
Importance du code couleur dans la soumission eSTAR à FDA
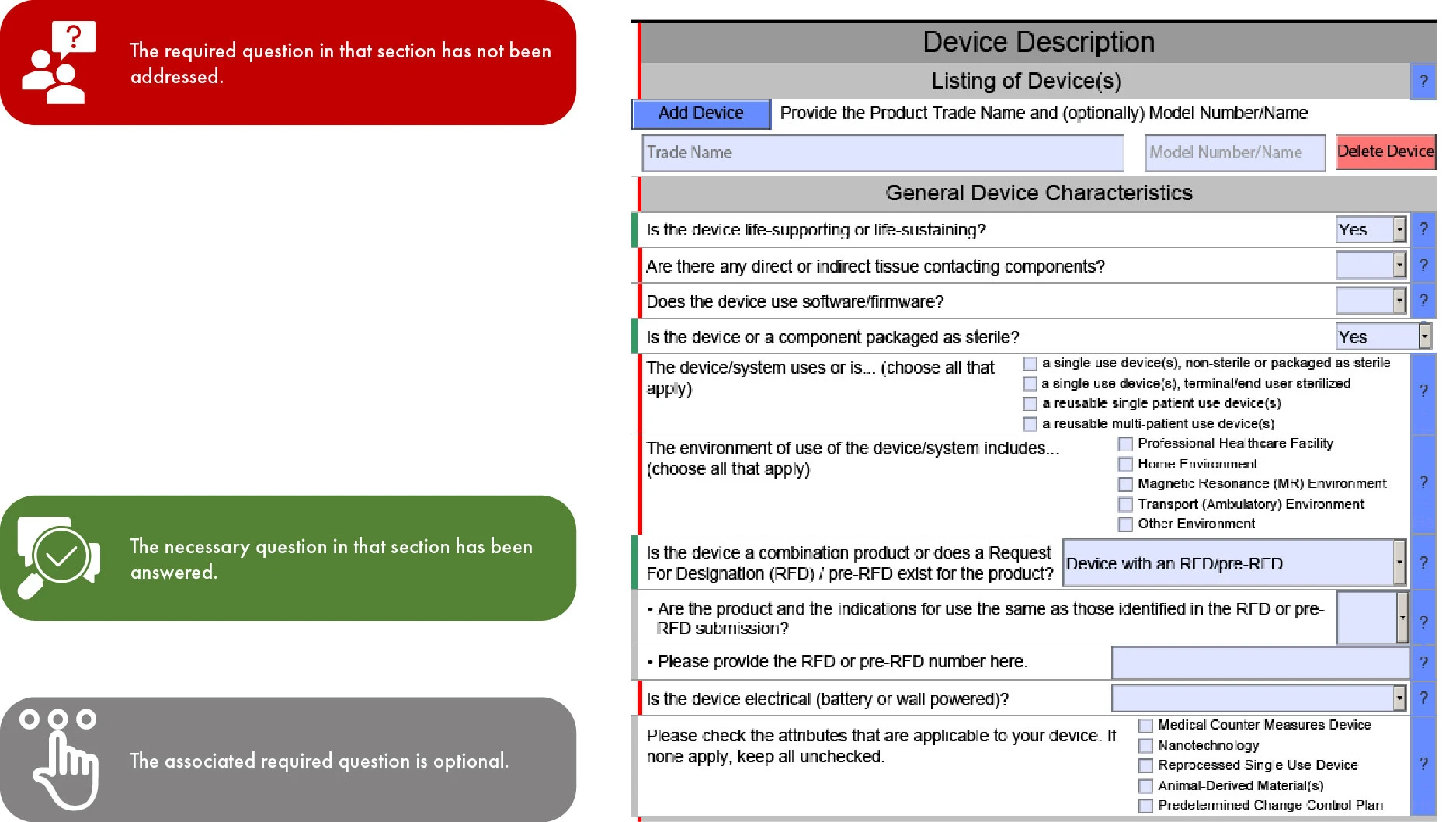
Étant donné que l'utilisation d'eSTAR deviendra obligatoire pour les soumissions 510(k) à compter du 1er octobre 2023 et restera facultative pour les soumissions De Novo, le déroulement du modèle à travers les différentes sections est déterminé par le type de soumission. Ce type de rationalisation facilite un examen plus rapide par laFDA US , minimisant ainsi les incohérences et les omissions dans votre soumission. Cependant, il est important de noter que la FDA retarder son examen si les traductions en anglais des documents fournis font défaut.

Alignez vos pièces jointes
Examinez le modèle eSTAR au préalable pour comprendre comment les pièces jointes sont divisées et assurez-vous que vos documents s'alignent sur les sections des pièces jointes. Cette étape est cruciale, en particulier pour les entreprises qui ont déjà présenté des demandes 510(k), car votre approche actuelle de l'organisation des documents peut nécessiter des ajustements. Il peut également être nécessaire d'extraire le contenu des pièces jointes.
- eSTAR exige des pièces jointes concises, ce qui diffère des soumissions traditionnelles.
- Attendez-vous à de nombreuses pièces jointes, voire des dizaines.
- Les pièces jointes permettent d'inclure des données telles que des feuilles de calcul Excel, des fichiers vidéo MP4, des documents Word, des fichiers JPEG, etc.
- eSTAR souhaite des numéros de page pour les informations jointes, mais ne suggère pas l'utilisation d'une liste de contrôle de refus d'acceptation pour les orientations de FDA .
Modèles : Les modèles sont accessibles à partir du lien suivant :fda.
L'avenir d'eSTAR
Il est prévu que l'eSTAR fasse l'objet de mises à jour dès que les documents d'orientation applicables auront été finalisés. Grâce à ces mises à jour, le fabricant pourra se référer aux versions les plus récentes publiées par laFDA US .
Health Canada (SC) a lancé une initiative pilote visant à utiliser eSTAR pour les dispositifs de classe III et IV. On peut penser que d'autres pays pourraient suivre l'exemple du Canada en rendant l'adoption d'eSTAR discrétionnaire, en particulier au sein du consortium IMDRF. Toutefois, il convient de noter qu'il n'y a pas eu de déclaration explicite à cet effet.
Pourquoi choisir Freyr?
Freyr s'enorgueillit d'une grande expertise acquise grâce à son implication dans de nombreux projets axés sur les soumissions à la FDA dans le passé. En présentant des voies doubles pour aider proactivement l'industrie à accélérer les soumissions 510(k) et De Novo, Freyr fournit un éventail de services aux clients, qui comprennent une liste complète des documents de soumission essentiels et des informations requises, la réalisation d'analyses méticuleuses des lacunes dans la documentation, la compilation des soumissions via eSTAR, et la finalisation du dossier de soumission pré-commercialisation à la FDA. En outre, Freyr apporte son soutien aux activités postérieures à la soumission, telles que la fourniture d'informations supplémentaires et l'examen des réponses de l'industrie à toute demande d'informations complémentaires formulée par la FDA.
Quelle est l'utilité de Freyr ?
Freyr offre un soutien qui peut être utile pour se préparer aux soumissions 510(k) et De Novo. Les services proposés sont les suivants :
- Soutien à la voie réglementaire: Il s'agit d'identifier le code du produit, le nom et le numéro du règlement, les dispositifs prédictifs/de référence potentiels, les tests de performance, ainsi que les normes et les documents d'orientation applicables au dispositif spécifique en question.
- Assistance à la soumission Q (pré-soumission) : Il s'agit de vous aider à clarifier les questions relatives aux conditions préalables à une demande d'autorisation de mise sur le marché, à organiser la demande, à vous préparer à une réunion de la FDA , à dialoguer avec la FDA pendant la réunion de manière interactive et à rédiger le procès-verbal de la réunion.
L'expertise du programme eSTAR de FDA
- Stratégie réglementaire globale de FDA .
- Identification du dispositif prédicat.
- Établir l'équivalence en substance avec le dispositif prédicat.
- Analyse des lacunes pour la conformité avec la FDA .
- Compilation de vingt-et-une (21) sections du dossier technique 510(k).
- Publication et création de la copie électronique.
- Validation et soumission de la copie électronique.
- Assurer la liaison avec les services pour l'approbation des dispositifs.
- L'examen des réponses et des lacunes du CRT.
- Services de consultation pour remédier aux déficiences.
- Liste des appareils et maintenance de la base de données FURLS.