Protocole de recherche et d'analyse de la littérature sur les dispositifs médicaux - Vue d'ensemble
Dans le domaine complexe des dispositifs médicaux et du diagnostic in vitro (DIV), l'importance d'un protocole de recherche documentaire sur les dispositifs médicaux et d'une analyse bien structurée transcende la simple exploration de la recherche. Elle apparaît comme la pierre angulaire de la mise en conformité avec les exigences strictes en matière de sécurité et de performance définies par des réglementations telles que le règlement de l'Union européenneEU MDR dispositifs médicauxEU MDR) 2017/745 et le règlement de l'Union européenne relatif au diagnostic in vitro (EU IVDR) 2017/746.
Revue de la littérature sur EU MDR
L'analyse documentaire joue un rôle crucial dans la gestion du cycle de vie d'un dispositif médical. Une stratégie systématique de recherche documentaire EU MDR est l'épine dorsale du succès de l'évaluation clinique, de l'évaluation des performances, ainsi que de la surveillance post-commercialisation et des rapports de suivi clinique/de performance post-commercialisation. Ancrée dans une stratégie de recherche documentaire systématique, cette étude n'est pas seulement une phase, mais aussi une balise qui guide vers une prise de décision éclairée.
Le pouvoir d'une équipe de synthèse de la littérature scientifique robuste
Les fabricants qui naviguent dans le domaine complexe des dispositifs médicaux et des DIV ont besoin de plus qu'une analyse documentaire de routine. Une solide équipe de synthèse de la littérature scientifique, dotée d'une expertise dans le domaine thérapeutique, est la boussole qui les guide dans le labyrinthe des exigences réglementaires, garantissant que la conformité n'est pas seulement respectée, mais qu'elle est en fait dépassée.
Protocole de recherche documentaire de lEU MDR
Les phases suivantes constituent le processus du protocole de recherche documentaire de l EU MDR :
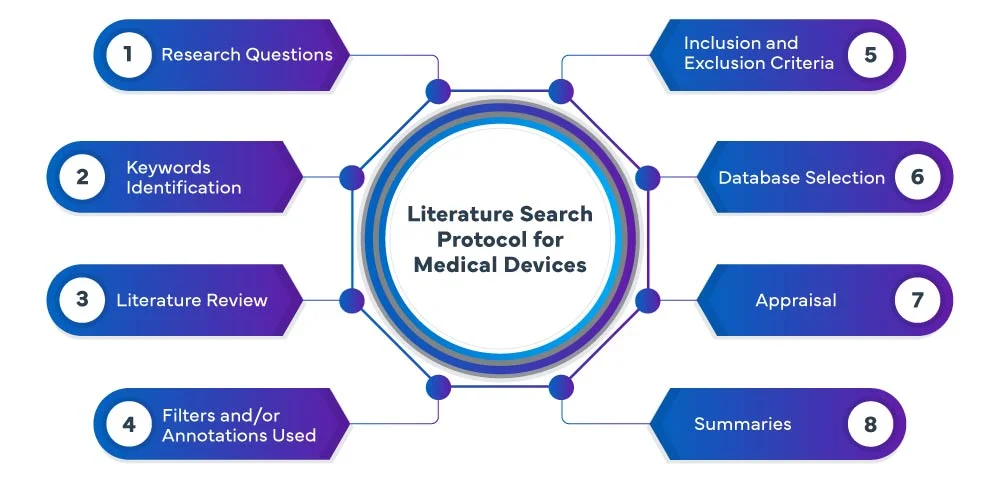
Chez Freyr, nous effectuons une recherche systématique et exhaustive de la littérature sur les dispositifs médicaux dans diverses bases de données, notamment PubMed, Embase et Cochrane, afin d'identifier les études et les publications pertinentes relatives à votre dispositif médical. Notre équipe utilise des stratégies de recherche avancées pour s'assurer de recueillir toutes les données pertinentes. Nous analysons et résumons méticuleusement les résultats, vous fournissant ainsi une étude complète qui sert de base au processus de développement ou d'évaluation de votre dispositif.
Nous reconnaissons que chaque dispositif médical est unique et que chaque catégorie de produits nécessite des solutions sur mesure. Nous travaillons en étroite collaboration avec vous pour comprendre vos besoins et vous fournir des services personnalisés qui répondent efficacement à vos objectifs.
Protocole de recherche de la littérature sur les dispositifs médicaux et examen
- Identifier, rechercher, analyser et rassembler la littérature scientifique appropriée.
- Stratégies de recherche et d'inclusion/exclusion des critères.
- Identifier la base de données appropriée pour le rapport de recherche documentaire, conformément aux exigences.
- Rassembler les données de la littérature.
- Examen de la littérature pertinente.
- Intégration des données PMS (le cas échéant).
- Documenter et rendre compte.
- Création du Clinical Evaluation Report (CER), conformément à la réglementation EU MDR 2017/745 de EU MDR
- Création d'un Clinical Evaluation Plan (CEP) pour votre organisation.
- Réaliser une évaluation des lacunes des PEC existants.

- Assurer la conformité avec les récentes réglementations applicables.
- Une équipe d'experts cliniques qualifiés.
- Évolutivité de l'équipe.
- Des solutions adaptées à vos besoins.
- Contributions interfonctionnelles d'experts en dispositifs médicaux pour se conformer aux exigences.
- Service complet de conformité, d'examen et de planification.





