Présentation générale de l'enregistrement des dispositifsFDA auprès deFDA US
Les États-Unis d'Amérique (USA) sont réputés pour être un marché hautement réglementé en matière de dispositifs médicaux, avec des procédures et des exigences d'enregistrement bien définies. Les premières réglementations américaines relatives aux dispositifs médicaux remontent à 1976 et ont évolué au fil du temps. Elles sont réglementées par le Centre for Devices and Radiological Health (CDRH) sous l'égide de la Food and Drug Administration (FDA). Freyr a aidé de nombreux fabricants de dispositifs à se conformer au processus d'enregistrement des dispositifsFDA US .

Autorité de régulation : Administration des aliments et des médicamentsFDA
Règlement : Titre 21 Code of Federal Regulations (21 CFR) Parties 800 - 1299
Voie réglementaire : Notification préalable à la mise sur le marché ou Approbation préalable à la mise sur le marché ou Classification De-Novo
Représentant autorisé : Agent américain
Exigence du SMQ : Règlement sur les systèmes de qualité (QSR) (21 CFR part 820)
Évaluation des données techniques : Centre pour les dispositifs et la santé radiologique
Validité de la licence : Illimité
Exigences en matière d'étiquetage : 21 CFR Partie 801
Format de soumission : Papier et CD/DVD
Langue : Anglais
Classification des dispositifs médicaux États-Unis
La FDA classe les dispositifs médicaux en trois catégories fondées sur le risque : classe I, classe II et classe III. Les dispositifs de classe I sont considérés comme des dispositifs à faible risque, tandis que ceux de classe III sont associés à un risque élevé. Les exigences en matière d'enregistrement et les voies d'accès varient en fonction de la classe du dispositif.
| Classe d'appareil | Risque | Parcours d'inscription pour approbation |
|---|---|---|
| I | Risque faible | Exemption 510(k) |
| II | Risque modéré (Avec dispositif prédicatif) | Notification préalable à la mise sur le marché/510(k) |
Risque modéré (sans prédicat) | Application De-Novo | |
| III | Risque élevé | Approbation préalable de mise sur le marché (APM) |
Agent de FDA États-Unis
Les entreprises qui ne disposent pas de bureaux locaux aux États-Unis doivent désigner un FDA américainpour représenter le fabricant. FDA américain doit soit résider aux États-Unis, soit disposer d'un établissement commercial aux États-Unis. Les responsabilités qui incombent à l'agent sont prédéterminées par laFDA US FDA le cadre des réglementations CFR.
Parcourezla foire aux questions (FAQ) sur US .
Réunions interactives avec laFDA US
FDA US FDA les fabricants à travers différents types de réunionsQ-Submissionafin d'atteindre divers objectifs. Ces réunions avec l'agence avant le lancement ou pendant le développement d'un dispositif, avant le dépôt des demandes d'enregistrement de dispositifsFDA auprèsFDA US , aident les fabricants à optimiser les délais et les coûts liés à la commercialisation des dispositifs.
Enregistrement des dispositifs médicaux aux États-Unis
Les dispositifs peuvent être approuvés par le CDRH et la FDA par le biais de l'une des différentes voies d'enregistrement. Ils sont répertoriés comme suit
Dispositifs médicaux de classe I :les dispositifs de classe I sont généralement exemptés des exigences GMP et 510(k) et ne nécessitent pas d'autorisation préalable de laFDA US FDA être commercialisés aux États-Unis. D'autres exigences telles que l'enregistrement de l'établissement, l'inscription du dispositif, l'UDI, le PMS, etc. doivent être respectées par le fabricant.
Dispositifs médicaux de classe II :les dispositifs à risque moyen dont les dispositifs de référence ont été approuvés selon la procédure 510(k) peuvent opter pour la notification préalable à la mise sur le marché (PMN) 510(k), également appeléeenregistrement 510(k). Le dispositif concerné doit établir une équivalence substantielle (SE) avec les dispositifs de référence identifiés et revendiqués. Cette voie est la plus largement adoptée pour l'enregistrement des dispositifs aux États-Unis. Les fabricants de dispositifs à risque moyen sans dispositifs de référence peuvent demander une classification par laFDA US FDA demandes De-Novo.
Dispositifs médicaux de classe III :les fabricants de dispositifs de classe III à haut risque doivent soumettre une demande d'autorisation préalable à la mise sur le marché (PMA) à laFDAUS . Les dispositifs doivent faire l'objet d'une évaluation clinique détaillée et le fabricant doit fournir des données détaillées sur la sécurité et l'efficacité issues d'études cliniques. LaFDA US FDA une inspection du système de gestion de la qualité dans le cadre de l'évaluation avant de délivrer uneautorisation préalable à la mise sur le marchépour le dispositif.
Enregistrements de dispositifs médicaux non-CDRH
Sur la base des indications d'utilisation, certains produits de la ligne de démarcation sont considérés comme des dispositifs médicaux dans d'autres pays, tels que les respirateurs chirurgicaux, les désinfectants, les produits combinés, et impliquent d'autres agences telles que le Centre for Disease Control (CDC), le National Institute for Occupational Safety and Hazards (NIOSH), l'Environmental Protection AgencyEPA, le Centre for Biological Evaluation and Research (CBER), le Centre for Drug Evaluation and Research (CDER).
Exigences de conformité post-approbation pour les dispositifs médicaux
Tous les fabricants de dispositifs doivent se conformer aux exigences de post-approbation énumérées ci-dessous :
- Exigences en matière d'enregistrement et d'inscription: Les établissements de toutes les classes de dispositifs doivent être enregistrés dans la base de données de la FURL et le dispositif doit être répertorié après l'obtention de l'approbation et avant la commercialisation du dispositif aux États-Unis. Certains dispositifs, tels que les dispositifs de radiothérapie, doivent satisfaire à d'autres exigences, telles que le numéro d'enregistrement, avant de pouvoir être importés aux États-Unis.
- Identification unique de l'appareil: Toutes les classes de dispositifs doivent se conformer à la réglementation relative à l'identification unique des dispositifs (UDI) pour pouvoir être commercialisés aux États-Unis.
- Frais d'établissement: Le fabricant doit s'acquitter des frais d'établissement annuels afin de maintenir son enregistrement en vigueur et de continuer à commercialiser ses dispositifs aux États-Unis. LaFDA US FDA réduit la structure tarifaire pour les petites entités titulaires d'un certificat de petite entreprise en activité.
- Audits qualité: pourles dispositifs qui ne sont pas exemptés des BPF, la FDA US FDA inspecter à tout moment l'établissement de fabrication afin de vérifier sa conformité aux réglementations relatives aux systèmes qualité (QSR) conformément au 21 CFR 820.
Déroulement du processus
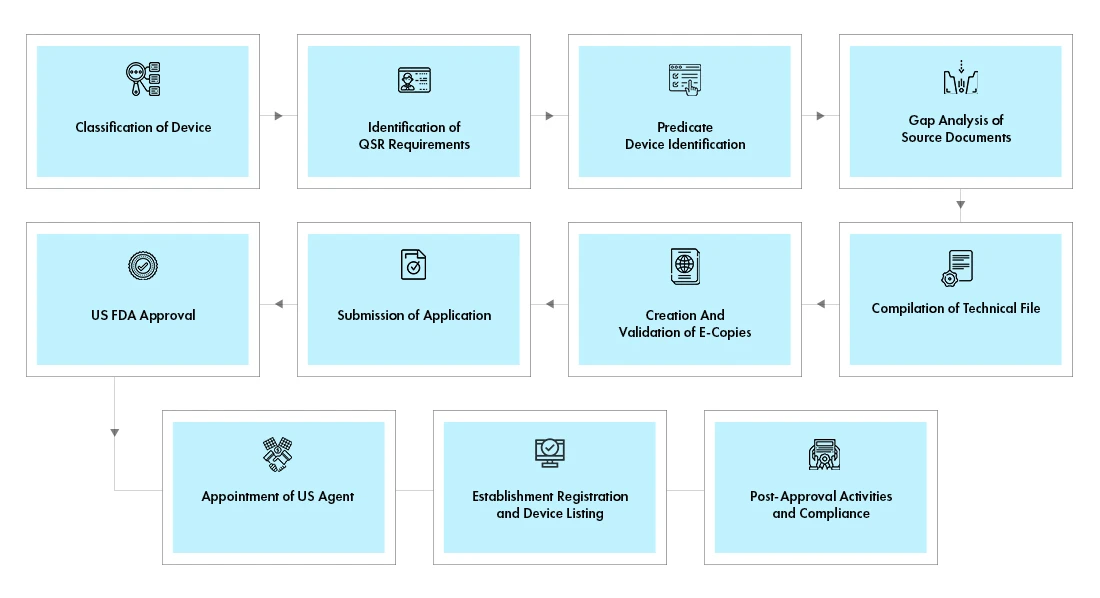
Gestion du cycle de vie des appareils après leur approbation
Freyr aide les fabricants étrangers dans la gestion end-to-end du cycle de vie des dispositifs end-to-end , y compris les activités post-autorisation, telles que :
- Gestion des modifications après approbation - modifications des approbations de dispositifs médicaux existants, telles que l'ajout de nouvelles variantes, d'accessoires, l'ajout de nouvelles indications d'utilisation, etc.
- Maintien des approbations et des enregistrements par le paiement en temps voulu des redevances MDUFA à la FDA
- Assurer la liaison entre laFDA US FDA le fabricant
Freyr dispose d'un centre de livraison exclusif aux États-Unis avec une équipe professionnelle pour fournir un soutien réglementaire aux fabricants dans le maintien de la qualité et de la sécurité nécessaires à l'approbation. Les experts de Freyrobservent attentivement les mises à jour réglementaires et informent les clients des mesures à prendre pour que les produits soient conformes aux normes en vigueur.
Résumé
| Risque | Classe d'appareil | Audit du SMQ | Disponibilité des prédicats | Voie réglementaire | Agent américain | US FDA |
|---|---|---|---|---|---|---|
| Risque faible | I | Non | NA | Exempté | Oui | 1 mois |
| Risque moyen | II | Oui (approbation a posteriori) | Oui | PMN/510(k) | Oui | 9 - 12 mois |
| Risque moyen | II | Oui (approbation a posteriori) | Non | Demande de classification De-Novo | Oui | 18 - 30 mois |
| Risque élevé | III | Oui (approbation préalable) | NA | PMA | Oui | 18 - 30 mois |
Services d'enregistrement des dispositifs médicaux de Freyr
Expertise Freyr
- Due-Diligence réglementaire
- Documentation sur les appareils
- 513(g) soutien
- Enregistrement 510(k)
- Demande de classification De-Novo
- Inscription à la PMA
- 21 CFR 820 conformité
- Soutien à l'audit BIMO
- MDSAP Conformité
- Aide à l'étiquetage
- Aide à la publication et à la soumission
- Agent américain
- Q-Réunions de présentation
- Réunions de l'appel d'offres et réunions préalables à l'appel d'offres
- Certification des petites entreprises
- Enregistrement des établissements et liste des dispositifs
- Conformité réglementaire des dispositifs médicaux à rayonnement
- Gestion des changements après approbation
- Surveillance post-marché
- Conformité UDI
- Conseil en matière de réglementation pour remédier aux déficiences