Aperçu de l'enregistrement des dispositifs médicaux au Royaume-Uni
Après le Brexit, le Royaume-Uni continue de modifier et d'ajouter ses réglementations en matière de dispositifs médicaux. Les réglementations à suivre dans le pays sont divisées géographiquement - Grande-Bretagne (GB) et Irlande du Nord (NI). La Medicines and Healthcare Products Regulatory Agency (MHRA) est l'autorité réglementaire qui s'occupe des dispositifs médicaux. L'Irlande du Nord est tenue de se conformer aux règlements de l'Union européenne sur les dispositifs médicaux (EU MDR) 2017/745 et aux règlements sur les dispositifs de diagnostic in vitro (IVDR) 2017/746. Les fabricants non britanniques doivent nommer une personne responsable britannique (UK RP) pour les aider à se conformer à ces réglementations et garantir la réussite du processus d'enregistrement des dispositifs médicaux au Royaume-Uni.
Autorité de régulation : Agence de réglementation des médicaments et des produits de santéMHRA
Règlement : Règlement sur les dispositifs médicaux (MDR) 2002*
Voie réglementaire : Marquage CE suivi d'une notification
Représentant autorisé : Personne responsable au Royaume-Uni (UK RP) pour les fabricants non britanniques
Exigence du SMQ : ISO 13485:2016
Évaluation des données techniques : Organismes agréés au Royaume-Uni pour le marquage UKCA
Marques valables : GB - UKCA ou CE & NI - CE ou CE + UKNI
Format de soumission : Papier
Format de soumission : En ligne
*Le futur règlement sur les dispositifs médicaux s'appliquera à partir du 1er juillet 2025.
Classification des dispositifs médicaux au Royaume-Uni
Les classifications britanniques des dispositifs médicaux sont basées sur le MDR 2002 du Royaume-Uni. La classification du dispositif est la toute première étape du processus d'obtention de l'autorisation et de lancement sur le marché.
Classification des dispositifs médicaux
| Classe | Risque |
|---|---|
| Classe I | Faible |
| Classe IIa | Moyen |
| Classe IIb | Moyen |
| Classe III | Haut |
Classification des DIV
- DIV général
- Autocontrôle des DIV
- DIV relevant de la liste A de l'annexe II
- DIV relevant de la liste B de l'annexe II
Notre société est spécialisée dans la classification des dispositifs médicaux. À ce jour, Freyr a mené à bien la classification de dispositifs pour plus de 50 entreprises au Royaume-Uni.
Services de la personne responsable du Royaume-Uni (UKRP)
Les fabricants non britanniques sont désormais tenus de désigner obligatoirement l'UKRP pour mettre leurs produits sur le marché.
Freyr s'est enregistré avec succès et peut maintenant agir en tant qu'UKRP. Pour obtenir plus de détails sur nos services UKRP, veuillez consulter le site www.ukrpservices.com.
Enregistrement des dispositifs médicaux
Les fabricants devront désormais désigner un organisme agréé par le Royaume-Uni pour obtenir le marquage UKCA. Bien que le marquage CE soit autorisé, il n'est applicable que pendant une certaine période. Les délais de transition sont mentionnés ci-dessous -
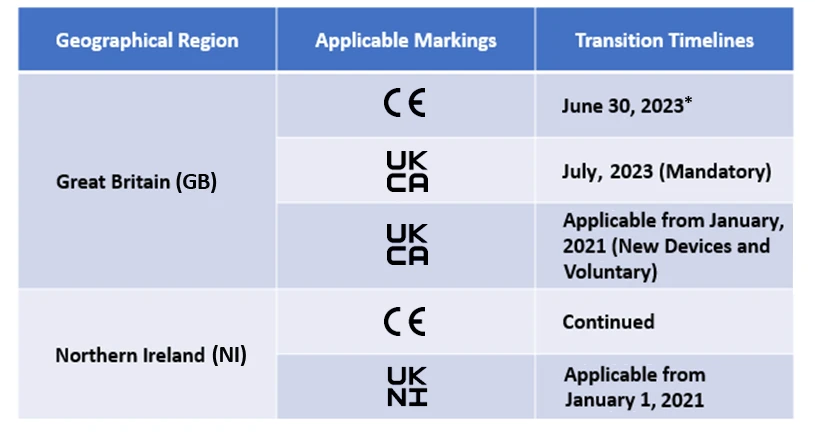
Freyr soutient actuellement de nombreux fabricants dans le cadre des transitions post-brexit.
*Le calendrier de transition actuel pour le marquage CE dans le cadre de l'EU MDR IVDR est reconnu par la MHRA britannique et les délais diffèrent en fonction du champ d'application des dispositifs.
Exigences en matière de surveillance après la mise sur le marché
Les exigences en matière de surveillance post-commercialisation prévues par le MDR 2002 du Royaume-Uni sont très strictes afin de garantir la sécurité et l'efficacité pour le patient/l'utilisateur. Actuellement, les activités de surveillance post-commercialisation comprennent le signalement des incidents/constatations à la MHRA. La MHRA a publié des orientations détaillées à ce sujet.
Enregistrement des dispositifs médicaux au Royaume-Uni
Expertise Freyr
- Classification des dispositifs médicaux au Royaume-Uni
- Soutien à la transition réglementaire après le Brexit
- Soutien réglementaire pour la notification de la MHRA au Royaume-Uni
- Personne responsable au Royaume-Uni (UKRP)
- Liaison et soutien avec l'agence de santé et l'organisme agréé