Aperçu du Software as a Medical Device SaMD
Le Software as a Medical Device SaMD est le dernier sujet en plein essor dans le secteur des soins de santé. Le marché du SaMD devrait croître à un taux de croissance annuel composé (TCAC) de 10,78 % à l'échelle mondiale. Cette croissance est stimulée par divers facteurs tels que l'adoption de l'internet des objets (IoT), les plateformes numériques de soins de santé et l'adoption de logiciels de surveillance continue des paramètres physiologiques par les prestataires de soins de santé pour l'assistance à distance. Cependant, ce paysage prometteur présente également des défis uniques, l'un d'entre eux étant de déterminer s'il entre dans la catégorie des dispositifs médicaux et adhère aux exigences réglementaires.
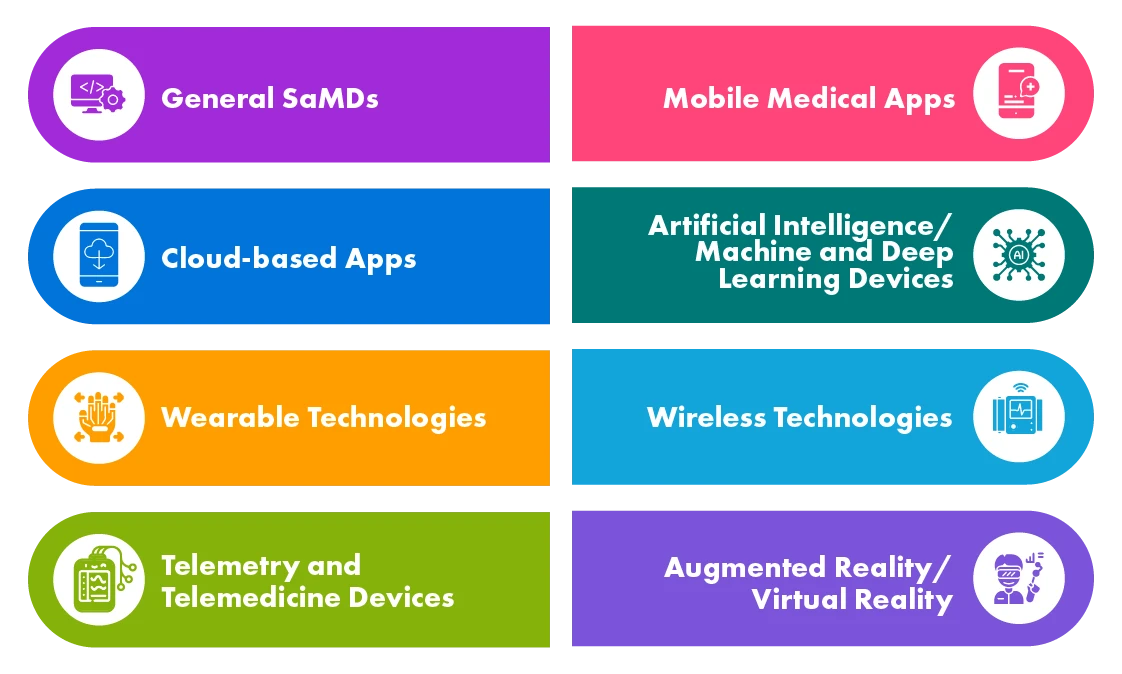
Différents types de produits de santé numérique
Scénario réglementaire mondial pour l'enregistrement des Software as a Medical Device SaMD
Les SaMD sont utilisés dans diverses applications telles que le dépistage et le diagnostic, la surveillance et l'alerte, la gestion des maladies, etc. Les agences de santé des pays développés tels que l'UE, les US, le Canada et l'Australie ont défini des réglementations relatives aux SaMD et certaines d'entre elles ont déjà élaboré des documents d'orientation, tandis que d'autres sont en train de le faire.
Certains marchés réglementés et non réglementés considèrent les logiciels comme des dispositifs médicaux, mais ne disposent pas de lignes directrices différenciées et spécifiques pour la classification des Software as a Medical Device SaMD. Ils suivent les lignes directrices harmonisées internationalement acceptées pour l'évaluation et l'approbation des logiciels.
Vous trouverez ci-dessous quelques-unes des principales lignes directrices relatives à l'enregistrement des Software as a Medical Device SaMD Software as a Medical Device SaMD:
- Orientations de l'IMDRF pour la classification, le Quality Management System (QMS), l'évaluation de la cybersécurité et l'évaluation clinique.
- L'EU MDR 2017/745 a détaillé les exigences réglementaires et les conseils pour cette catégorie de dispositifs.
- Le guide du MDCG sur la qualification et la classification des SaMD, les Clinical Evaluation Reports (CER) et les rapports d'évaluation des performances (PER) pour les SaMD
- FDA US sur la cybersécurité, l'évaluation clinique et les exigences d'enregistrement pour différents types de logiciels tels que les systèmes décisionnels, les systèmes d'archivage et de communication d'images (PACS), les applications mobiles, etc.
- Document d'orientation de Health Canada sur la définition et la classification des SaMD
- Les nouvelles réglementations de la TGA pour les dispositifs médicaux basés sur des logiciels.
L'enregistrement de SaMD sur d'autres marchés mondiaux est traité au cas par cas et nécessite une interaction étroite avec l'agence de santé concernée pour l'approbation. La procédure générale suivie pour l'enregistrement des SaMD és comprend les étapes suivantes :
- Déterminer si un logiciel donné peut être considéré comme un SaMD.
- Classification des dispositifs en fonction du risque encouru.
- Identifier les normes applicables et les exigences en matière de données de l'agence de santé concernée.
- Générer les données requises par l'agence concernée.
- Compilation du dossier technique selon les exigences du pays.
- Soumission et résolution des questions jusqu'à l'approbation.
- Gestion du cycle de vie post-approbation.
Nos compétences
- Regulatory Intelligence Services (marché + soutien à l'étiquetage)
- Due Diligence réglementaire / Rapports stratégiques
- Qualification et classification des SaMD
- Classification des produits Application à l'ON
- Analyse des lacunes - Gap Analysis
- Réunions de pré-soumission avec la FDA
- Identification des normes applicables
- Activités de gestion des risques
- Soutien à la gestion des risques
- Soutien à l'étiquetage
- Création/révision/mise à jour des procédures/modèles spécifiques aux SaMD
- UDI/ GUDID
- Enregistrement du produit (enregistrement du logiciel)
- Enregistrement de l'établissement
- Liste des appareils
- SaMD de l'AH aux demandes de renseignements - services SaMD
Pourquoi Freyr?
Foire aux questions (FAQ)
La réglementation des logiciels médicaux est supervisée par divers organismes réglementaires internationaux, dont la FDA aux États-Unis, l'EMA en Europe et le PMDA au Japon. Ces agences classent les logiciels médicaux en fonction du risque et établissent des lignes directrices en matière de sécurité, de qualité et d'efficacité. La conformité aux normes ISO, telles que ISO 13485 et 62304, est requise.
Pour déterminer la classification des risques d'un Software as a Medical Device SaMD, il faut évaluer des facteurs tels que l'utilisation prévue et les dommages potentiels. Les logiciels en tant que dispositifs médicaux sont classés comme les dispositifs médicaux traditionnels en fonction de l'importance des informations fournies pour la prise de décision en matière de soins de santé et de l'état de la situation ou de la condition en matière de soins de santé : non grave, grave ou critique. Les lignes directrices réglementaires et la consultation d'experts sont cruciales dans ce processus, car elles garantissent la conformité et la sécurité des patients.
SaMD désigne un logiciel destiné à être utilisé à une ou plusieurs fins médicales, sans faire partie d'un dispositif médical physique. Il fonctionne sur des plateformes informatiques générales telles que les smartphones, les tablettes ou les ordinateurs personnels. En revanche, le SiMD est un logiciel qui fait partie intégrante d'un dispositif médical physique et qui contribue à sa fonctionnalité et à ses performances. Le SiMD ne peut pas être utilisé de manière indépendante et dépend du dispositif médical associé pour remplir la fonction pour laquelle il a été conçu.
Un logiciel qui fait partie intégrante d'un dispositif médical matériel et qui est nécessaire à la réalisation de l'objectif médical prévu N'EST PAS considéré comme un SaMD.
Le calendrier de mise en conformité avec SaMD dépend de la classe de risque et des exigences réglementaires. Cependant, avec une assistance réglementaire appropriée, vous pouvez garantir un processus de mise en conformité sans heurts et avec un minimum de risques.
Enregistrement des dispositifs médicaux
- Stratégie réglementaire globale pour les SaMD.
- Soutien à la réglementation et à l'intelligence économique.
- Services de classification et d'enregistrement des produits pour les ministères de la santé.
- Soutien réglementaire pour les documents de développement des produits SaMD .
- Services de consultation sur les études d'évaluation clinique de SaMD .
- Gestion des changements post-approbation.
- Service de représentation locale.

- Stratégie réglementaire globale pour les SaMD.
- Soutien à la réglementation et à l'intelligence économique.
- Services de classification et d'enregistrement des produits pour les ministères de la santé.
- Soutien réglementaire pour les documents de développement des produits SaMD .
- Services de consultation sur les études d'évaluation clinique de SaMD .
- Gestion des changements post-approbation.
- Service de représentation locale.





