
Dans le monde en constante évolution des dispositifs médicaux, la conformité n'est pas une tâche ponctuelle, c'est un engagement permanent. Le contrôle et la mise à jour continus des rapports clés tels que les rapports d'évaluation clinique (CER), les rapports d'évaluation des performances (PER) et les rapports périodiques de mise à jour de la sécurité (PSUR) sont essentiels tout au long du cycle de vie d'un dispositif médical, de la recherche initiale à la surveillance après la mise sur le marché. Le paysage des progrès médicaux et des exigences réglementaires évoluant sans cesse, la garantie de la sécurité et de la conformité des dispositifs médicaux et des DIV grâce à une rédaction médicale efficace reste la pierre angulaire du succès et de la viabilité à long terme.
Voyons comment la gestion du cycle de vie reste essentielle au succès d'un dispositif médical.
Le lancement d'un dispositif médical est l'aboutissement d'années d'efforts consacrés à plusieurs phases telles que la recherche, le développement, les essais cliniques, les soumissions réglementaires et la surveillance post-commercialisation. Ce processus s'étend sur de nombreuses années et chaque phase accumule des données vitales en grande quantité, qui doivent être soigneusement compilées et analysées pour garantir que le dispositif reste sûr.
La conformité n'est pas une affaire ponctuelle, et une gestion efficace du cycle de vie permet d'éviter les retards qui peuvent s'avérer coûteux par la suite. Ces retards sont souvent dus à une planification inefficace des changements réglementaires imprévus ou de la non-conformité, qui peuvent avoir été négligés. Les mises à jour régulières des documents essentiels tels que les CER, les PER et les PSUR garantissent que les fabricants respectent les exigences réglementaires en constante évolution et préservent la sécurité des produits. La gestion du cycle de vie garantit que les fabricants, dès le départ, ont planifié chaque étape, ce qui leur permet d'éviter les écueils et d'assurer la réussite de la mise sur le marché et la longévité de leurs dispositifs.
Respectez-vous les règles de conformité ?
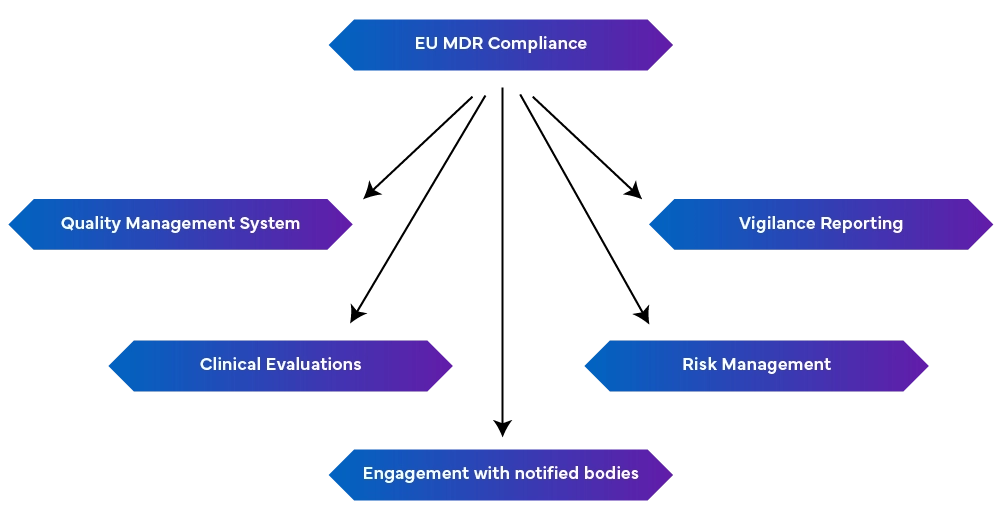
Des pansements aux implants, l'industrie des dispositifs médicaux est un secteur de pointe, créatif et riche en perspectives. Malgré la volonté des fabricants de fournir au marché des produits sûrs et de grande qualité, l'ambiguïté demeure. Le EU MDR dispositifs médicaux a remplacé la directive sur les dispositifs médicaux (DDM) et la directive sur les dispositifs médicaux implantables actifs (DMIA). Ce règlement a été mis en œuvre pour imposer des contrôles plus rigoureux, améliorer la sécurité des patients et promouvoir une plus grande transparence dans le secteur des soins de santé. Ces normes suscitent de nombreuses incertitudes et les questions cruciales de conformité sont souvent négligées. Cependant, les fabricants de dispositifs médicaux devraient prendre des mesures pour éviter les difficultés liées à la réglementation.
Examinons les défis les plus courants auxquels sont confrontés les fabricants de dispositifs médicaux.
- Gestion des CAPA (Corrective and Preventive Action)
- Respect des procédures de plainte
- Respect des procédures de vigilance
- Évaluation clinique et surveillance post-commercialisation
- Connexion avec les organismes notifiés
Meilleures pratiques pour rester en conformité
Pour relever ces défis, Freyr a mis en place
-unsystème de gestion de la qualité robuste (EN ISO 13485:2016) : Ce système englobe les aspects liés à la production, notamment la conformité réglementaire, la documentation technique, les déclarations de conformité à l'UE et la gestion des risques.
-Rapports de vigilance : Maintenir les rapports de vigilance comme un processus continu plutôt que comme un effort ponctuel.
- Gestion proactive des risques: Elle permet d'identifier et d'atténuer les risques tout au long du cycle de vie de l'appareil en procédant à des mises à jour régulières pour faire face aux risques émergents.
- Procéder à des évaluations cliniques et à une surveillance après la mise sur le marché: Il s'agit de démontrer la sécurité et les performances du dispositif à l'aide de données cliniques. Si nécessaire, des investigations cliniques doivent être effectuées et les évaluations cliniques doivent être régulièrement mises à jour à l'aide de données de surveillance post-commercialisation. Des rapports périodiques de mise à jour de la sécurité résumant les résultats sont également nécessaires.
- En relation avec les organismes notifiés: Les changements de réglementation peuvent avoir une incidence sur les exigences du MDR. Il est donc essentiel d'entretenir de bonnes relations avec les organismes notifiés pour obtenir rapidement des mises à jour et des modifications.
Comment un expert en réglementation peut vous aider
Il n'est pas toujours facile de se tenir au courant de l'évolution constante du paysage réglementaire. Alors pourquoi ne pas laisser un expert vous guider dans ce labyrinthe ? La gestion des exigences réglementaires du cycle de vie d'un dispositif médical n'est pas seulement complexe, elle exige aussi beaucoup de ressources. Dans le cas des petites entreprises, où les ressources internes peuvent être mieux utilisées dans d'autres domaines, l'aide d'un partenaire réglementaire externe peut s'avérer indispensable. Il offre une connaissance spécialisée des réglementations en évolution et veille à ce que vos rapports clés - tels que les CER, les PER et les PSUR - soient continuellement mis à jour et conformes.
Vous pouvez éviter des retards coûteux, prévenir la non-conformité et rationaliser votre processus d'approbation. En outre, un expert en réglementation peut proposer des solutions sur mesure en fonction des besoins spécifiques de votre dispositif, en veillant à ce que la surveillance post-commercialisation, l'analyse des lacunes et l'ensemble de la documentation de conformité soient à jour. Leur implication peut simplifier le processus global, minimiser les risques et garantir que le dispositif peut répondre aux attentes en matière de sécurité et de performance.
Freyr peut vous aider à répondre à tous vos besoins réglementaires en matière de gestion du cycle de vie. Reach dès aujourd'hui !









