
La publicité pharmaceutique, y compris la publicité destinée directement aux consommateurs, est réglementée respectivement par le Bureau de la promotion des médicaments sur ordonnance (OPDP) de la Food and Drug Administration (FDAUS , la Division de la publicité et de l'étiquetage promotionnel (APLB) du Centre d'évaluation et de recherche sur les médicaments (CDER) et le Centre d'évaluation et de recherche sur les produits biologiques (CBER). Les informations soumises à l'OPDP et à APLB être exactes, éthiques et non trompeuses. Des informations supplémentaires sur les avantages et les risques du produit doivent être incluses dans la soumission. Les bureaux examinent également les supports promotionnels soumis à l'Agence.
En avril 2022, laFDA US FDA des directives concernant les soumissions relatives à l'étiquetage promotionnel et au matériel publicitaire. Ces directives aident à comprendre la soumission électronique dans le module 1 de l'eCTD, en utilisant la version 3.3 ou supérieure du fichier US. Le document mentionne les types de supports promotionnels qui ne sont pas soumis à la soumission électronique obligatoire en vertu de la section 745A. Les copies papier de tous les types de soumissions promotionnelles seront acceptées jusqu'à vingt-quatre (24) mois après publication des directives.
Exception
Le document stipule que les soumissions en vertu de l'article 505(b), (i) ou (j) de la loi fédérale sur les aliments, les médicaments et les cosmétiques (FD&C Act) et les soumissions en vertu de l'article 47 351(a) ou (k) de la loi sur les services de santé publique (PHS Act) doivent être soumises sous forme électronique, tel que défini par la FDA. Ce document n'est pas soumis aux restrictions habituelles prévues par les réglementations FDAen matière de bonnes pratiques d'orientation, car il n'est pas établi légalement pour des responsabilités exécutoires. Par conséquent, la partie de cette orientation qui établit l'exigence de soumissions électroniques en vertu de l'article 745A(a) de la FD&C Act a un effet contraignant, comme l'indique l'utilisation des termes « doit », « doit » ou « requis ».
La FDA le matériel promotionnel rédigé dans les quarante-cinq (45) jours suivant sa soumission volontaire par les promoteurs. Pour toute question relative au produit soulevée par les professionnels de santé, les consommateurs, les promoteurs de médicaments ou les cabinets d'avocats, l'OPDP accorde aux promoteurs un délai de trente (30) jours calendaires pour y répondre.
Définition du matériel promotionnel
L'expression « matériel promotionnel » désigne les étiquettes promotionnelles et les supports publicitaires, quels que soient leur format, leur mode de communication ou leur support. La FDA supervise FDA deux (02) types d'étiquetage pour les médicaments :
- Étiquetage FDA
- Étiquetage promotionnel
Conformément à la section 201(m) FDA, l'étiquetage est défini comme « toutes les étiquettes écrites, imprimées ou graphiques en relief sur tout contenant, emballage ou article, ou accompagnant un tel article ». L'expression « accompagnant un tel article » est considérée comme une interprétation ou une explication du matériel promotionnel, comme l'a déclaré la Cour US .
Critères de soumission du matériel promotionnel pour examen
- Inclusion des BLA NDA, ANDA ou BLA appropriés
- Dans les cas où les demandeurs ont besoin d'un examen immédiat, les soumissions doivent être adressées au gestionnaire de projet de l'OPDP.
- À partir du formulaire FDA , attribuez le type de matériel le plus spécifique pour représenter le matériel promotionnel.
- Les différents types de matériel doivent être soumis séparément
- Ne pas mélanger d'autres soumissions avec du matériel promotionnel
- Le matériel promotionnel destiné aux professionnels de la santé doit être soumis séparément de celui destiné aux consommateurs.
Les paramètres ci-dessous précisent le nombre de formulaires 2253 soumis et les documents inclus dans ces soumissions.
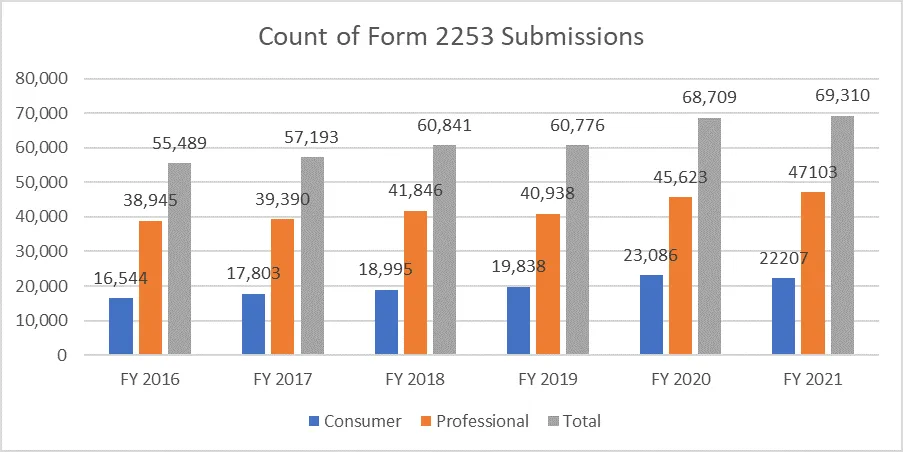
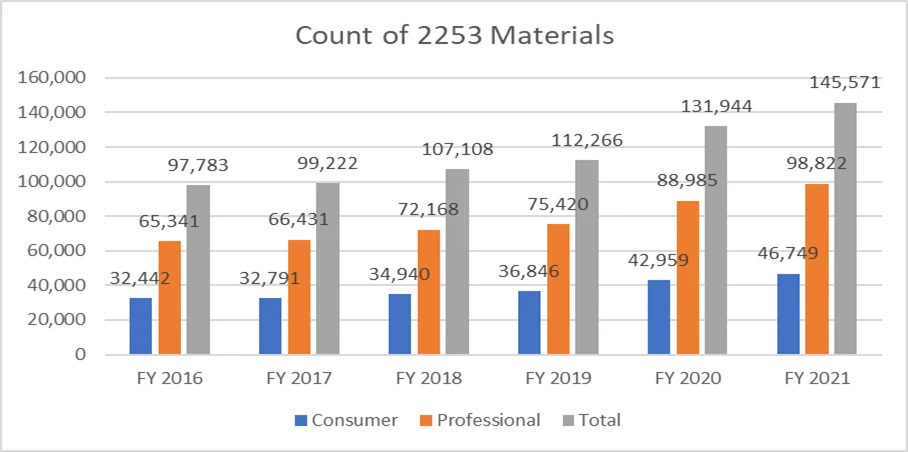
Il est primordial que les promoteurs rédigent leur matériel promotionnel conformément aux directives fournies par la FDA éviter de multiples cycles d'examen, compte tenu du coût du processus. Disposer de ressources capables de faciliter le processus de soumission du matériel promotionnel peut permettre aux promoteurs d'atteindre leurs objectifs commerciaux et de se conformer aux exigences réglementaires. Un partenaire réglementaire éprouvé tel que Freyr garantir un examen complet du matériel promotionnel et non promotionnel avant sa soumission, qu'il soit sous forme électronique ou non. Contactez Freyr dès aujourd'hui pour rédiger du matériel promotionnel clair, concis et conforme dès la première fois.









