Alors que les médicaments innovants ou de marque entraînent des coûts supplémentaires liés à la recherche et au développement du produit, depuis le stade de l'identification de la molécule jusqu'à l'autorisation de mise sur le marché, les médicaments génériques sont relativement rentables. Ces thérapies permettent non seulement de réduire le coût global du traitement, mais aussi d'améliorer considérablement l'accès des patients à des médicaments vitaux. Étant donné que la dépendance à l'égard de l'importation d'antibiotiques génériques et de médicaments contre les maladies rares a affecté la disponibilité de ces produits pharmaceutiques au niveau mondial pendant la pandémie, les agences de santé introduisent de nouvelles lignes directrices pour soutenir les fabricants de médicaments locaux.
Depuis 1993, l'organisation commerciale Medicines for Europe, anciennement connue sous le nom de European Generics Medicine Association (EGA), a poursuivi son objectif de familiariser la population européenne avec des thérapies rentables. Au cours de la dernière décennie, elle a réussi à fournir 67 % de tous les médicaments à l'Europe, élargissant l'accès des patients à 100 % dans sept (07) domaines thérapeutiques clés. Dans le cadre des compétences des autorités de santé européennes, une "autonomie stratégique" après le Brexit a déclenché une exigence immédiate pour remédier efficacement au désavantage concurrentiel auquel sont confrontés les fabricants européens de génériques et de biosimilaires. Avec l'arrivée de la pandémie de COVID-19, les capacités de la chaîne d'approvisionnement mondiale ont succombé sous la pression de la demande de médicaments. Les médicaments vitaux qui permettaient de soulager les maladies chroniques ont disparu des rayons des pharmacies locales. Afin de surmonter les obstacles liés aux produits pharmaceutiques protégés par un brevet et de renforcer les capacités locales de fabrication de médicaments pour améliorer l'accès des patients, le Conseil de l'UE a adopté un règlement qui prévoit une exception pour une molécule originale en fournissant un certificat complémentaire de protection (CCP). Cette disposition facilite la fabrication de génériques et de biosimilaires avant l'expiration du brevet à des fins de stockage ou d'exportation. Toutefois, l'exception ne sera applicable que dans les circonstances suivantes.
- Les génériques ou biosimilaires produits sont exclusivement destinés à l'exportation vers un autre pays où le brevet pour la molécule de médicament n'existe pas ou a expiré, ou à des fins de stockage pendant la durée de validité du brevet de six (06) mois.
- Conformément à l'exigence, le fabricant a transmis l'information à l'autorité sanitaire locale et au titulaire du CPS avant trois (03) mois.
- Le fabricant a informé tous les acteurs concernés par la commercialisation du produit.
- Le fabricant s'est assuré que les exigences en matière d'étiquetage stipulent que le produit pharmaceutique indique qu'il est uniquement destiné à l'exportation.
En fait
Depuis l'octroi de l'autorisation conditionnelle de mise sur le marché des produits vaccinaux COVID-19 dans l'UE, le Comité des médicaments humains (CHMP) de l'Agence européenne des médicaments a autorisé quatre (04) sites de production de vaccins en l'espace d'un an : deux (02) en Suisse et deux (02) aux États-Unis. Ces décisions en faveur de l'expansion des sites de production renforceront les capacités de fabrication de vaccins tout en les rendant plus accessibles à la population européenne.
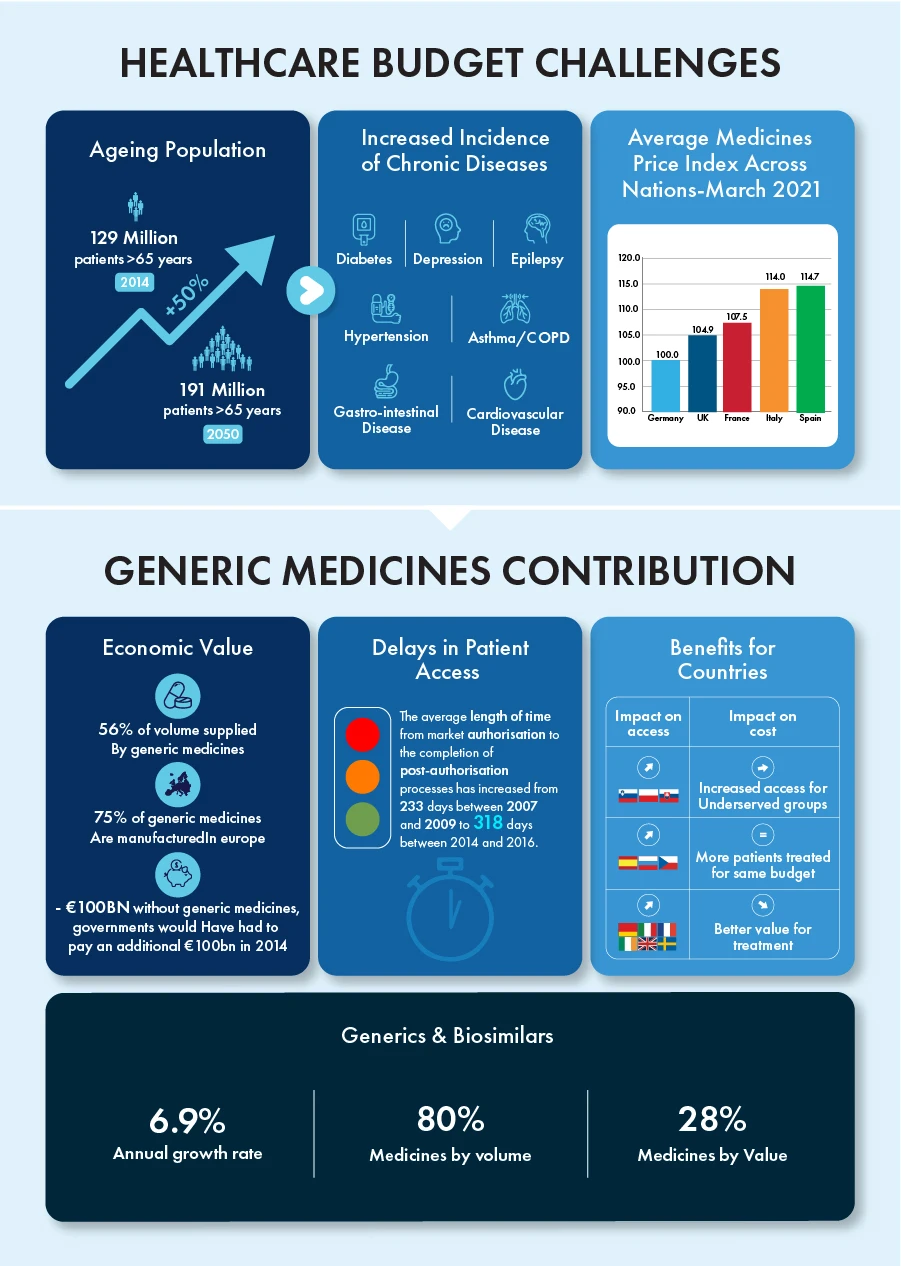
Les génériques et les biosimilaires ont contribué à eux seuls à un taux de croissance annuel de 6,9 %, tout en représentant 80 % de tous les médicaments en volume et 28 % en valeur au cours de la dernière décennie. Les brevets de certains produits biologiques, évalués à environ 90 milliards d'euros, prendront fin d'ici à 2023, ce qui créera un environnement concurrentiel pour ces produits au potentiel de croissance considérable.
La mise en œuvre d'une dérogation au CPS serait bénéfique pour l'Union européenne :
- Ce qui représente environ 90,5 milliards d'euros supplémentaires par an.
- Création de vingt-cinq mille (25 000) nouveaux emplois, dont deux mille (2 000) emplois directs pour le secteur des API dans l'UE. Cette initiative permettra member states de l'UE member states 3,1 milliards d'euros en dépenses de santé.
- Stocker des alternatives moins chères aux médicaments brevetés innovants pour leur permettre d'entrer sur le marché immédiatement après l'expiration de la propriété intellectuelle (PI), améliorant ainsi l'accès des patients.
Pour un fabricant de médicaments basé en dehors de l'Union européenne, la mise en œuvre de la dérogation au CCP est l'une des initiatives les plus gratifiantes en faveur des génériques. Étant donné que l'Autorité européenne de santé réglemente les médicaments à usage humain et vétérinaire par le biais d'une procédure centralisée ou décentralisée, il peut être très difficile de s'y retrouver parmi les exigences locales spécifiques. Un expert, connaissant les exigences locales en matière de soumissions et de documents d'autorisation, peut vous aider à concentrer vos efforts sur les protocoles de production essentiels plutôt que de vous focaliser sur les obstacles réglementaires complexes. Réinventez le potentiel de votre entreprise en faisant l'expérience de la conformité et de la qualité. Contactez Freyr.









