La rédaction réglementaire joue un rôle crucial dans l'industrie pharmaceutique et le secteur des soins de santé, en faisant le lien entre des informations scientifiques complexes et les différentes parties prenantes. L'art d'adapter la rédaction réglementaire à différents publics est essentiel pour une communication et une conformité efficaces. Ce blog explorera comment adapter la rédaction réglementaire à trois (3) publics clés : les patients, les cliniciens et les autorités de réglementation.
Comprendre l'importance d'une rédaction adaptée au public cible
La rédaction réglementaire englobe divers documents, chacun servant un objectif spécifique et ciblant des lecteurs différents. La capacité à adapter le contenu à ces différents publics est essentielle pour garantir que les informations sont exactes, mais aussi accessibles et exploitables.
Points de repère primaires considérant l'approche de l'adaptation :
Écrire pour les patients : Simplifier les informations complexes
Lors de la rédaction de documents réglementaires destinés aux patients, l'objectif principal est de transmettre les informations essentielles de manière claire et compréhensible, sans sacrifier la précision.
- Utilisation d'un langage clair et simple
Utilisez des mots courants et évitez le jargon technique. Lorsque des termes médicaux sont nécessaires, fournissez des explications claires.
- Aides visuelles et formatage
Incorporez des diagrammes, des graphiques et des infographies pour illustrer des concepts complexes. Utiliser des puces, des titres et des paragraphes courts pour améliorer la lisibilité.
- Répondre aux préoccupations communes
Anticiper et répondre aux éventuelles questions ou inquiétudes des patients concernant le médicament ou le traitement.
Exemple : Brochures d'information à l'intention des patients
Ces documents doivent

Rédiger pour les cliniciens : Équilibrer les détails et l'aspect pratique
Les cliniciens ont besoin d'informations complètes mais concises pour prendre des décisions éclairées concernant les soins aux patients. Les textes réglementaires destinés à ce public doivent trouver un équilibre entre les détails scientifiques et l'applicabilité pratique.
- L'accent mis sur la pertinence clinique
Se concentrer sur les informations ayant un impact sur les soins aux patients, telles que les directives de dosage, les contre-indications et les interactions médicamenteuses.
- Présentation structurée des données
Organiser les résultats des essais cliniques et les données de sécurité dans un format logique et facile à consulter. Utilisez des tableaux et des graphiques pour résumer les principaux résultats.
- Inclusion de recommandations fondées sur des données probantes
Fournir des conseils clairs et fondés sur des données probantes concernant l'utilisation appropriée d'un médicament ou d'un dispositif médical dans divers scénarios cliniques.
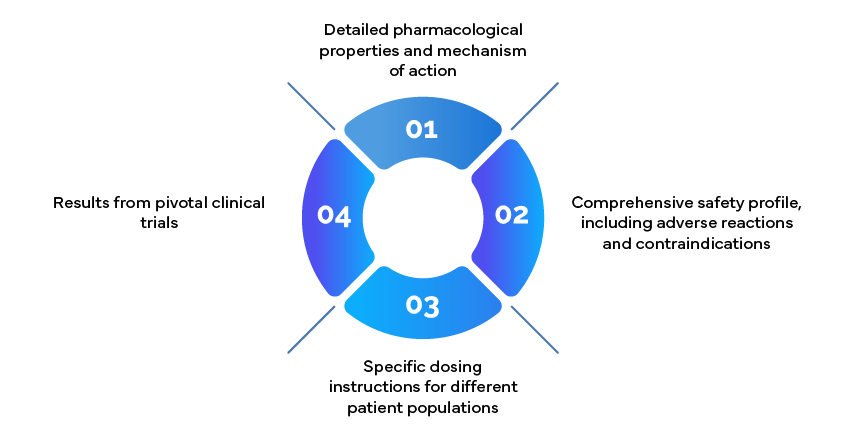
Exemple : Informations relatives à la prescription
Les documents d'information sur les prescriptions, également connus sous le nom de notices, sont des ressources cruciales pour les cliniciens. Ils doivent comprendre
Écrire pour les régulateurs : Précision et conformité
Les agences réglementaires exigent une documentation exhaustive et scientifiquement rigoureuse pour évaluer la sécurité et l'efficacité des nouveaux produits. La rédaction de documents destinés à ce public exige une attention méticuleuse aux détails et un respect strict des directives réglementaires.
- Respect des lignes directrices réglementaires
Veillez à ce que tous les documents soient conformes aux exigences spécifiques en matière de format et de contenu des organismes de réglementation tels que la FDA EMA.
- Présentation complète des données
Fournir une analyse approfondie de toutes les données pertinentes, y compris des descriptions détaillées des méthodologies d'étude, des analyses statistiques et de l'interprétation des résultats.
- Transparence des rapports
Indiquer les limites ou les biais potentiels de la recherche et expliquer comment ces facteurs peuvent influer sur les conclusions.
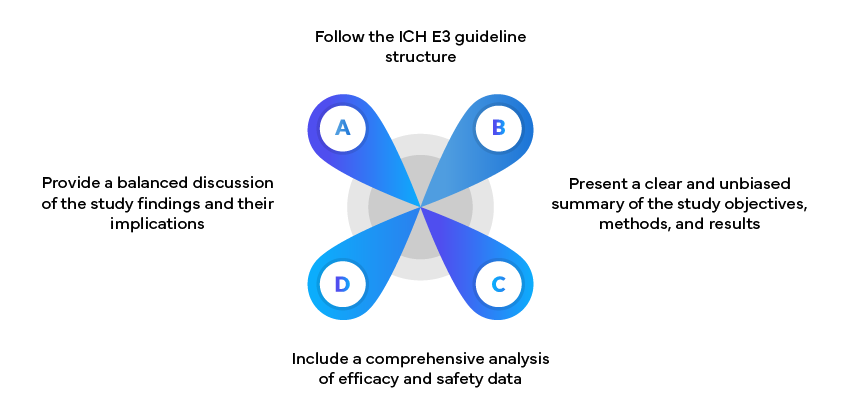
Exemple : Rapports d'études cliniques
Les rapports d'étude clinique (CSR) sont des documents essentiels pour les soumissions réglementaires. Ils doivent :
Conclusion
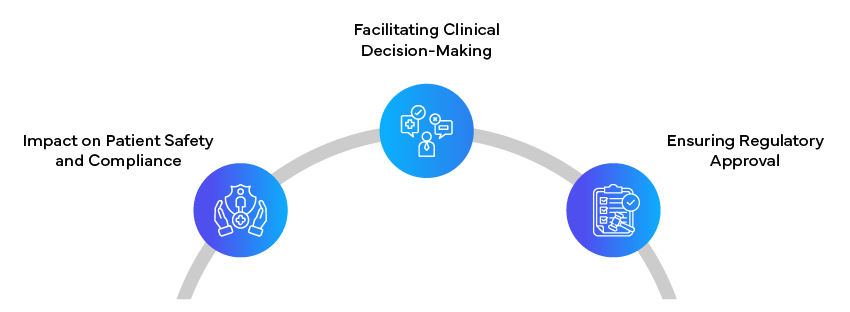
Adapter la rédaction réglementaire à différents publics est une tâche complexe mais essentielle dans l'industrie pharmaceutique et le secteur des soins de santé. En adaptant le contenu et les styles de présentation aux besoins spécifiques des patients, des cliniciens et des autorités de réglementation, les rédacteurs peuvent s'assurer que les informations essentielles sont communiquées et comprises de manière efficace.
La capacité à rédiger des documents réglementaires clairs, précis et adaptés au public n'est pas seulement une question de conformité ; elle a un impact direct sur la sécurité des patients, la prise de décision clinique et la réussite du développement et de la commercialisation de nouveaux produits de santé. Le paysage réglementaire continuant d'évoluer, l'importance d'une rédaction réglementaire qualifiée, capable de combler le fossé entre des données scientifiques complexes et les besoins des diverses parties prenantes, ne fera que croître. Les rédacteurs réglementaires jouent un rôle crucial dans l'avancement de la santé publique et la promotion de l'innovation dans le domaine médical en se concentrant sur la clarté pour le patient, la pertinence clinique pour les professionnels de la santé et la précision complète pour les régulateurs. La maîtrise de l'art de la rédaction réglementaire adaptée au public est donc une compétence inestimable dans l'environnement de santé actuel, qui évolue rapidement.









