
Medsafe, alias l'Autorité de sécurité des médicaments et des dispositifs médicaux de Nouvelle-Zélande, se charge de la réglementation des produits thérapeutiques en Nouvelle-Zélande. L'agence est une unité opérationnelle du ministère de la santé. Elle suit plusieurs législations pour réglementer les produits thérapeutiques, les principales étant le Medicines Act de 1981 et les Medicines Regulations. Le "but thérapeutique" est décrit dans la loi sur les médicaments comme le traitement, le diagnostic et la prévention des maladies ou la modification de l'activité physiologique.
Medsafe est responsable de la réglementation de plusieurs catégories de produits fabriqués, vendus ou fournis en Nouvelle-Zélande. Le diagramme suivant présente les différents types de produits.

Le cadre réglementaire de Medsafe comporte quatre (04) aspects importants liés aux médicaments et aux dispositifs médicaux. Ils sont décrits dans les lignes suivantes :
Contrôle de l'entrée et de la sortie du marché
Lors de la phase de pré-commercialisation des médicaments et des produits apparentés, il est important d'en évaluer la sécurité, la qualité et l'efficacité. Sur la base de ces données, Medsafe formule des recommandations au ministère, qui décide ensuite des mesures à prendre. Un médicament ne peut être mis à disposition sur le marché néo-zélandais que lorsque le ministère l'a approuvé.
Par la suite, dans la phase de post-commercialisation, tout signalement d'un effet indésirable peut entraîner le retrait de ces produits de l'utilisation. Les réglementations préalables et postérieures à la mise sur le marché s'appliquent uniquement aux médicaments (nouveaux et déjà approuvés (avec des changements dans l'ingrédient pharmaceutique actif (IPA)) et aux produits connexes.
En ce qui concerne les dispositifs médicaux, l'évaluation et l'approbation préalables à la mise sur le marché ne sont pas nécessaires aujourd'hui. Toutefois, les promoteurs doivent informer le ministère de leurs dispositifs afin qu'ils soient enregistrés dans une base de données gérée par Medsafe. Dans la phase de post-commercialisation, le ministère a le droit d'autoriser, de révoquer, de supprimer ou d'imposer des interdictions à la vente de dispositifs médicaux.
Qualité
Medsafe garantit la qualité des produits thérapeutiques en Nouvelle-Zélande de plusieurs manières. En voici les principaux :
- Établir des normes de qualité au stade de l'autorisation préalable à la mise sur le marché des médicaments
- Mise en œuvre des normes de qualité néo-zélandaises ou des normes de l'Organisation internationale de normalisation (ISO)
- Mise en place d'un système d'audit et d'autorisation pour les sponsors
- Garantir des normes de qualité grâce à une surveillance et à un contrôle constants
- Application des exigences relatives aux bonnes pratiques de fabrication (BPF)
Accès
Medsafe applique quelques mesures réglementaires pour contrôler l'accès aux médicaments uniquement. Le système de contrôle est basé sur la classification des médicaments, certains d'entre eux n'étant disponibles que par l'intermédiaire de professionnels de la santé qualifiés. La classification est effectuée par le Comité de classification des médicaments, qui travaille sous l'égide du ministère.
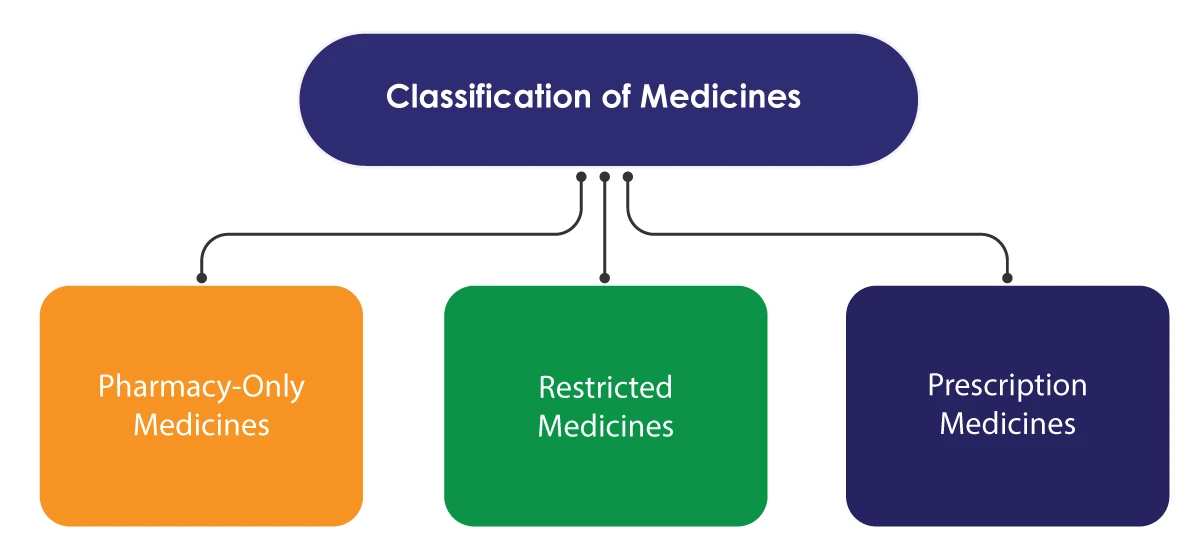
Les médicaments délivrés sur ordonnance ne sont vendus que sur prescription d'un professionnel de la santé. Les médicaments à usage restreint peuvent être vendus sans ordonnance mais doivent être fournis par un pharmacien agréé. La vente doit être enregistrée pour référence. Les médicaments vendus exclusivement en pharmacie peuvent être vendus dans les communautés, les pharmacies d'hôpitaux ou tout autre magasin autorisé à les vendre.
Il existe une autre catégorie connue sous le nom de "médicaments en vente libre". Les médicaments qui ne figurent pas dans les tableaux de classification de Medsafe relèvent de cette catégorie. Ils peuvent être vendus dans n'importe quel magasin.
Informations
Medsafe assume une autre fonction réglementaire majeure, à savoir la disponibilité d'informations précises sur les produits en Nouvelle-Zélande. Ces informations comprennent, entre autres, l'étiquetage, les données de prescription et les ordonnances pour les médicaments à usage restreint, ainsi que les contrôles de la publicité.
En tant que sponsor/fabricant souhaitant développer ses activités en Nouvelle-Zélande, vous aurez besoin du soutien d'un expert réglementaire reconnu tel que Freyr. us pour bénéficier de services et de solutions réglementaires complets et transparents.









