
Aperçu de l'enregistrement des dispositifs médicaux à Taiwan
Taïwan connaît une demande croissante de dispositifs médicaux. La Taiwan Food & Drug Administration (TFDA), qui dépend du ministère de la santé et des affaires sociales (MOHW), réglemente les dispositifs médicaux dans le cadre de la loi sur les affaires pharmaceutiques (PAA). Les fabricants étrangers qui n'ont pas de bureau physique à Taïwan doivent être représentés par un agent taïwanais, condition préalable à la procédure d'enregistrement des dispositifs médicaux à Taïwan.
Autorité de régulation : Administration taïwanaise des aliments et des médicaments
Règlement : Loi sur les affaires pharmaceutiques (PAA) et règlement pour l'enregistrement des dispositifs médicaux
Représentant autorisé : Représentation de l'agent taïwanais requise
Exigence du SMQ : Documentation du système de qualité (QSD) ISO 13485
Évaluation des données techniquesa : Division des dispositifs médicaux et des cosmétiques
Validité de la licence : QSD - 3 ans ; enregistrement du produit - 5 ans
Exigences en matière d'étiquetage : Article 75, loi sur les affaires pharmaceutiques
Format de soumission : Papier
Langue : Anglais et chinois
Classification des dispositifs médicaux à Taiwan
La TFDA classe les dispositifs médicaux en trois catégories en fonction du risque : La classe I pour les dispositifs à faible risque, la classe II pour les dispositifs à risque modéré et la classe III pour les dispositifs à risque élevé. La nécessité de disposer d'un dispositif prédicat pose des problèmes à l'entrée de nouveaux dispositifs sur le marché. L'allongement des délais de procédure pour les dispositifs de classe II et III nécessitant une documentation sur le système de qualité est un autre facteur de complexité. Tous les dispositifs médicaux importés doivent obtenir un certificat d'enregistrement auprès de la TFDA.
| Classe d'appareil | Risque |
|---|---|
| Classe I | Risque faible |
| Classe II | Risque modéré |
| Classe III | Risque élevé |
Représentation de l'agent taïwanais
Les fabricants étrangers qui n'ont pas de bureau physique à Taïwan doivent désigner un agent taïwanais comme condition préalable à la commercialisation de dispositifs à Taïwan. La désignation d'une organisation tierce en tant qu'agent taïwanais au lieu d'un distributeur offre la possibilité d'explorer plusieurs distributeurs pour une meilleure pénétration du marché. L'agent taïwanais doit avoir une entité juridique établie à Taïwan, certifiée par une licence de vente de produits pharmaceutiques.
Enregistrement des dispositifs médicaux à Taiwan
Avant qu'un dispositif médical puisse être vendu à Taïwan, l'enregistrement de la documentation du système de qualité (QSD) de l'installation de fabrication est requis en plus de l'enregistrement du dispositif médical. L'enregistrement QSD n'est supprimé que pour les dispositifs médicaux de classe I (non stériles). Une licence QSD (reçue après l'approbation de l'enregistrement QSD) à Taïwan est similaire aux bonnes pratiques de fabrication (BPF) pour les dispositifs médicaux.
La TFDA a annoncé qu'à partir du 1er juin 2022, les détenteurs de licences de dispositifs médicaux de classe III sont tenus de télécharger l'UDI et les informations correspondantes sur le produit dans la base de données UDI (UDID). Les fabricants de dispositifs médicaux sont également tenus de faire figurer l'UDI sur l'étiquette du produit. En outre, à partir du 1er juin 2023, les dispositifs médicaux de classe II devront se conformer aux réglementations pertinentes de l'UDI.
Déroulement du processus
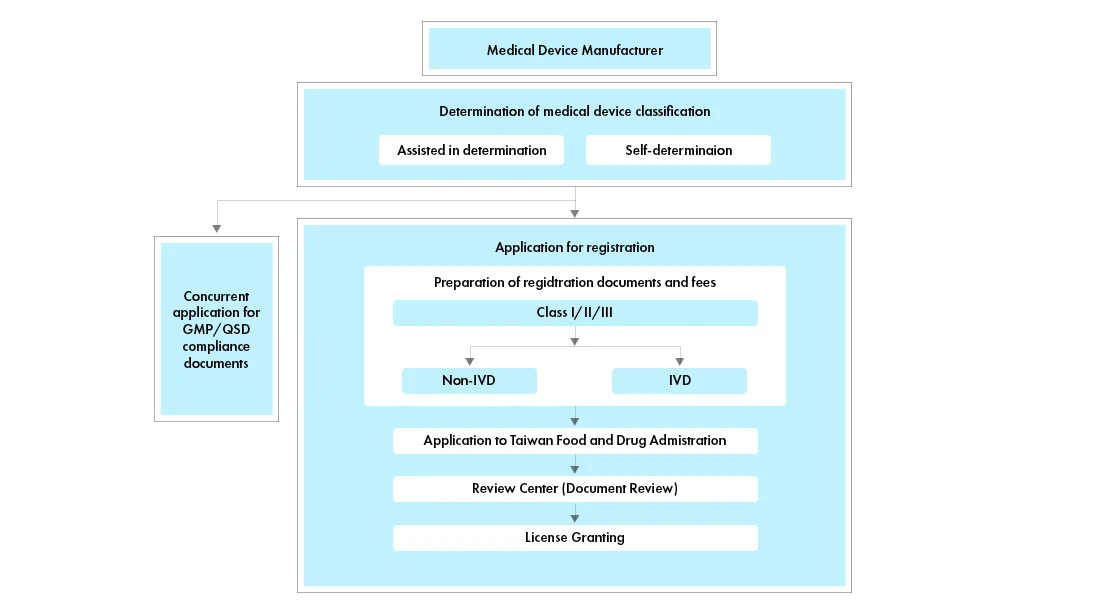
Gestion du cycle de vie des dispositifs médicaux après leur homologation
Freyr aide les fabricants étrangers dans la gestion end-to-end du cycle de vie des dispositifs end-to-end , y compris les activités post-autorisation, telles que :
- Gestion des modifications après approbation - modifications des approbations de dispositifs médicaux existantes telles que l'ajout de nouvelles variantes, d'accessoires, l'ajout de nouvelles indications d'utilisation, etc.
- Maintien des agréments et de l'enregistrement par le paiement en temps voulu des frais administratifs et d'enregistrement
- Renouvellement des licences
- Assurer la liaison entre la TFDA et le fabricant
- Gestion des importations
Freyr est spécialisé dans la satisfaction des besoins réglementaires des dispositifs médicaux à Taïwan. Grâce à son vaste réseau, Freyr aide à désigner un agent local fiable dont la présence est de la plus haute importance tout au long de la surveillance post-commercialisation. Nos experts aident également à la sélection d'un dispositif prédicat approprié et des approbations existantes sur d'autres marchés pour soutenir l'entrée d'un nouveau dispositif sur le marché.
Résumé
| Classe d'appareil | Risque / Critères de classification | QMS | Enregistrement du produit |
|---|---|---|---|
| Classe I | Risque faible | Exempté (dispositifs non stériles de classe I) | Oui |
| Classe II | Risque modéré | QSD | Oui |
| Classe III | Risque élevé | QSD | Oui |
Expertise Freyr
- Due-Diligence réglementaire
- Classification officielle
- Agréments QSD
- Enregistrement de l'appareil
- Représentant légal
- Aide à l'étiquetage
- Aide à la traduction
- Identification et qualification des distributeurs
- Surveillance post-marketing
- Gestion des changements après approbation
- Renouvellement et transfert de licence
- Soumission et liaison

