
Vue d'ensemble de l'enregistrement des dispositifs médicaux en Turquie
Le marché turc des dispositifs médicaux a connu une croissance significative et constante au cours de la dernière décennie. À partir de 2021, l'enregistrement des dispositifs médicaux en Turquie devra respecter le règlement de l'UE sur les dispositifs médicaux (MDR) 2017/745 et le règlement sur les dispositifs médicaux de diagnostic in vitro (IVDR) 2017/746. Cela a renforcé le commerce international, conduisant plusieurs entreprises mondiales à lancer leurs dispositifs médicaux dans le pays.
Autorité de régulation : Agence turque des médicaments et des dispositifs médicaux (TITCK)
Règlement : Règlement sur les dispositifs médicaux (MDR) 2017/745, Règlement sur les dispositifs de diagnostic in vitro 2017/746
Voie réglementaire : Le marquage CE est obligatoire et doit être suivi d'un enregistrement/notification dans le système de suivi des produits (UTS).
Turquie Représentant local autorisé : Représentant autorisé européen (EAR) pour les fabricants étrangers (hors UE/non-Turquie)
Exigence du SMQ : ISO 13485:2016
Évaluation des données techniques : Organisme notifié pour le marquage CE
Validité de la licence : Illimité
Format de soumission : Papier
Traduction : Documents traduits en turc
Classification des dispositifs
La Turquie suit la même classification des dispositifs médicaux que celle indiquée dans le EU MDR et l'IVDR de EU MDR . Déterminer la classification d'un dispositif peut s'avérer difficile, c'est pourquoi il est essentiel d'avoir l'appui d'un consultant expérimenté en matière de réglementation.
Classes de dispositifs médicaux -
| Classe | Risque |
|---|---|
| Classe I | Faible |
| Classe IIa | Modéré |
| Classe IIb | Modéré à élevé |
| Classe III | Haut |
Classes de dispositifs de diagnostic in vitro -
| Classe | Risque |
|---|---|
| Classe A | Faible |
| Classe B | Modéré |
| Classe C | Modéré à élevé |
| Classe D | Haut |
Turquie Représentant local autorisé
Désormais, grâce à l'accord d'union douanière, les fabricants de l'UE n'ont plus besoin de désigner un représentant local agréé pour mettre leurs appareils sur le marché.
Les autres fabricants étrangers sont tenus de désigner un représentant agréé européen (EAR) pour commercialiser les dispositifs sur le marché turc.
Enregistrement des dispositifs médicaux
Le marquage CE est une conformité exigée par les fabricants pour placer leurs appareils sur le marché turc. Le marquage CE est délivré à l'issue d'une évaluation de la conformité effectuée par l'organisme notifié. La Turquie est désormais autorisée à nommer des organismes notifiés conformément aux règlements EU MDR et IVDR de EU MDR .
Les entreprises sont tenues de s'enregistrer dans le système central d'enregistrement (MERSIS) et d'enregistrer le dispositif dans le système de suivi des produits (UTS).
Déroulement du processus
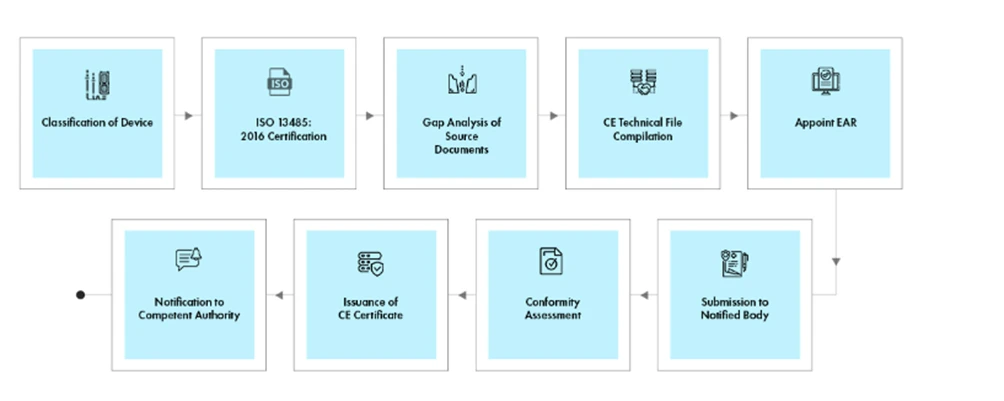
Gestion du cycle de vie des appareils après leur homologation
Freyr les fabricants étrangers dans la gestion end-to-end du cycle de vie des dispositifs end-to-end , y compris les activités post-autorisation, telles que :
- Gestion des modifications après approbation - modifications des approbations de dispositifs médicaux existants, telles que l'ajout de nouvelles variantes, d'accessoires, l'ajout de nouvelles indications d'utilisation, etc.
- Maintien de la certification ISO 13485:2016 et CE
- Renouvellement des licences
- Liaison entre l'organisme notifié et le fabricant
Compte tenu du nombre d'organismes d'autorisation impliqués, les fabricants étrangers doivent se conformer à plusieurs réglementations dans chaque processus individuel d'homologation des dispositifs. L'obtention du marquage CE et le respect des réglementations nationales nécessitent une connaissance approfondie de la réglementation. Sans un partenaire réglementaire éprouvé, il peut parfois être difficile pour les nouveaux entrants sur le marché de s'y retrouver parmi toutes les exigences relatives aux dispositifs. Afin d'aider les fabricants, Freyr des services end-to-end pour accélérer les homologations des dispositifs médicaux.
Expertise Freyr
- Classification européenne des dispositifs médicaux
- Soutien du représentant autorisé européen (EAR)
- Turquie Enregistrement des dispositifs et notification des produits
- ISO 14971:2019 Consultation sur la gestion des risques
- Conformité à la ISO 13485:2016
- Examen, compilation et soumission du dossier technique/de conception CE
- Soutien à la transition des EU MDR
- Soutien à la transition vers l'IVDR de l'UE
- Clinical Evaluation Reports (CER) pour les dispositifs médicaux
- Rapports d'évaluation des performances (PER) pour les dispositifs de diagnostic in vitro
- Notification/enregistrement des dispositifs médicaux via le système d'enregistrement en ligne
- Rapport sur la stratégie de réglementation des dispositifs médicaux
- Support d'essai - biocompatibilité, sécurité électrique, mécanique et performance
- Conformité du labelling
- Soutien aux BPF
- Soutien à la surveillance après la mise sur le marché

