Aperçu de l'enregistrement des dispositifs médicaux en Argentine
L'Argentine est l'un des pays d'Amérique latine qui se développe le plus rapidement et qui offre des opportunités aux entreprises de dispositifs médicaux, grâce à un système de santé réputé pour son attachement à la sécurité des patients et à la qualité des services médicaux. L'enregistrement des dispositifs médicaux en Argentine est supervisé par l'autorité réglementaire - l'Administration nationale des médicaments, des aliments et des dispositifs médicaux (ANMAT).

Autorité de régulation : Administration nationale des médicaments, des aliments et des dispositifs médicaux (ANMAT)
Règlement : Disposition 2318/2002, et Disposition 727/2013
Voie réglementaire : Système électronique de notification des dispositifs assistés par le web (WAND)
Représentant autorisé : Représentant autorisé de l'Argentine (AAR)
Exigences du SMQ: ISO 13485 (ANMAT MDS), et MDSAP (membre affilié)
Évaluation des données techniques : Administration nationale des médicaments, des aliments et des dispositifs médicaux (ANMAT)
Exigences en matière d'étiquetage : Annexe III.B de la disposition 2318/2002 et annexe V de la disposition 727/2013.
Format de soumission : Électronique (portail HELENA)
Langue : Espagnol
Classification des dispositifs médicaux en Argentine
Dans le cadre du processus réglementaire de l'ANMAT, la première étape pour déterminer la voie d'enregistrement et la conformité avec les réglementations argentines consiste à déterminer la classification du dispositif médical. En Argentine, les dispositifs sont classés en quatre (04) classes en fonction du risque (classes I à IV).
| Classe de dispositif médical | Critères |
|---|---|
| Classe I | Risque faible |
| Classe II | Risque faible - modéré |
| Classe III | Risque élevé - modéré |
| Classe IV | Risque élevé |
| Classe IVD | Critères |
|---|---|
| Classe A | Diagnostic de maladies non infectieuses ou non transmissibles. |
| Classe B | Diagnostic des maladies infectieuses, à l'exception de celles appartenant à la classe C. |
| Classe C | Diagnostic des maladies infectieuses sexuellement transmissibles ou transmises par le sang ou ses dérivés, ainsi que pour l'identification des groupes sanguins. |
| Classe D | Pour l'auto-évaluation. |
Représentant autorisé de l'Argentine (AAR)
Le titulaire de l'enregistrement d'un dispositif médical en Argentine est légalement responsable de l'enregistrement et de la commercialisation du dispositif dans le pays. Il peut s'agir du fabricant du dispositif ou d'un représentant local autorisé (RLA) en Argentine agissant au nom du fabricant.
Tous les dispositifs médicaux commercialisés en Argentine doivent être enregistrés auprès de l'ANMAT. La procédure d'enregistrement peut être complexe et prendre du temps, c'est pourquoi il est souvent recommandé aux fabricants étrangers de faire appel à un AAR pour les aider.
Enregistrement des dispositifs médicaux ANMAT
Le processus d'enregistrement des dispositifs médicaux de l'ANMAT est similaire aux processus de notification et d'enregistrement brésiliens, le degré d'examen requis pour l'approbation augmentant en fonction de la classification du dispositif (classe I, II, III et IV). Tous les fabricants de dispositifs médicaux doivent également se conformer à l'ANMAT-MDS, qui est l'équivalent argentin du BGMP et qui est également conforme à la ISO 13485:2016.
Déroulement du processus
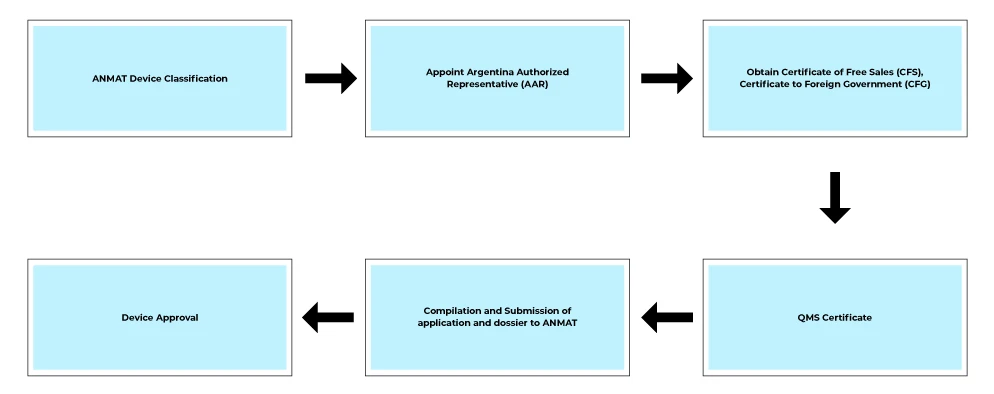
Services post-approbation
Freyr les fabricants étrangers à gérer le cycle de vie end-to-end des dispositifs end-to-end , y compris les activités post-autorisation, telles que :
- Gestion des modifications post-approbation - modifications apportées aux approbations de dispositifs médicaux existants, telles que l'ajout de nouvelles variantes, d'accessoires et de nouvelles indications d'utilisation, entre autres.
- Maintien des agréments et de l'enregistrement par le paiement en temps voulu des frais administratifs et d'enregistrement.
- Renouvellement des licences.
- Assurer la liaison entre ANMAT et le fabricant.
- Rapport sur les événements indésirables.
- Gestion des importations.
Freyr les fabricants à identifier la classification des dispositifs dans un premier temps. Freyr ses clients Freyr naviguer dans les méandres réglementaires et à obtenir les certifications nécessaires en les aidant à surmonter les obstacles réglementaires. Fort d'une expertise éprouvée dans le lancement de nombreux dispositifs dans la région, Freyr des services end-to-end pour les dispositifs médicaux.
Résumé
| Classe de dispositifs | Parcours d'inscription (notification ou inscription complète) | Calendrier des agences de santé | Validité de l'enregistrement (années) |
|---|---|---|---|
| Dispositifs de classe I | Inscription complète | 4 à 6 mois | 5 ans |
| Dispositifs de classe II | Inscription complète | 4 à 6 mois | 5 ans |
| Dispositifs de classe III | Inscription complète | 6-8 mois | 5 ans |
| Dispositifs de classe IV | Inscription complète | 6-8 mois | 5 ans |
*Veuillez noter que des facteurs tels que les limitations de la bande passante, les mises à jour réglementaires et d'autres variables peuvent entraîner une prolongation des délais des autorités sanitaires.
Expertise Freyr
- Services de rapports d'intelligence réglementaire.
- Services officiels de classification.
- Compilation de documents techniques.
- Services d'enregistrement des appareils.
- Services du représentant autorisé de l'Argentine (AAR).
- Services d'importation.
- Permis et autorisations d'exploitation.
- Services de traduction.
- Artwork d'étiquetage et Artwork .
- Services d'identification et de qualification des distributeurs.
- Surveillance après la mise sur le marché.
- Services de renouvellement et de transfert de licences.