Aperçu de l'enregistrement des dispositifs médicaux en Colombie
La Colombie offre de formidables opportunités aux entreprises de dispositifs médicaux. Son système de santé est réputé pour son engagement en faveur de la sécurité des patients et de la qualité des services médicaux, et régit les dispositifs médicaux par l'intermédiaire de l'INVIMA (Institut national de surveillance des aliments et des médicaments). INVIMA est l'autorité compétente pour l'enregistrement des dispositifs médicaux en Colombie.

Autorité de régulation : INVIMA (Institut national de surveillance des aliments et des médicaments)
Règlement : Décret 4725/2005
Voie réglementaire : Enregistrement de l'appareil
Représentant autorisé : Représentant légal en Colombie
Exigences du SMQ: ISO 13485:2016 / MDSAP
Évaluation des données techniques : INVIMA
Exigences en matière d'étiquetage : Les documents d'étiquetage doivent être rédigés en espagnol
Validité de la licence : 10 ans
Format de soumission : Électronique
Classification des dispositifs médicaux en Colombie
| Classification des dispositifs médicaux | |
|---|---|
| Classe I (risque le plus faible) | |
| Classe IIa | |
| Classe IIb | |
| Classe III (risque le plus élevé) | |
Représentant légal en Colombie
Pour être représentant légal en Colombie, il faut être citoyen colombien ou posséder l'autorisation légale nécessaire pour résider et travailler dans le pays en tant que ressortissant étranger. Un représentant légal peut aider et gérer toutes les procédures d'enregistrement en Colombie, en assurant la liaison entre l'entreprise et l'INVIMA, l'autorité réglementaire locale.
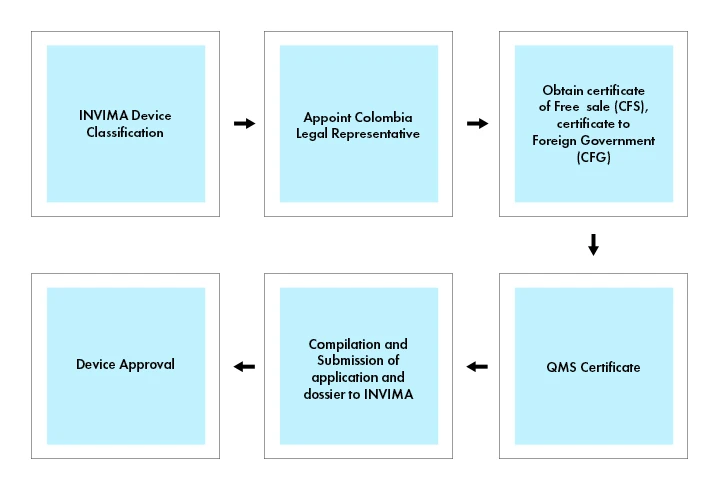
Enregistrement des dispositifs médicaux en Colombie
Les dispositifs médicaux et les DIV sont soumis à une procédure d'enregistrement. Les dispositifs médicaux doivent donc être enregistrés auprès de l'INVIMA pour être commercialisés en Colombie.
Pour commercialiser un dispositif médical en Colombie, il est nécessaire d'obtenir un certificat de vente libre (CFS) ou un certificat à un gouvernement étranger (CFG) délivré par l'organisme de réglementation compétent du pays d'origine ou d'un pays de référence reconnu (par exemple, le Canada, le Japon, l'Australie, l'Union européenne et les États-Unis). Le certificat de vente libre ou le certificat délivré à un gouvernement étranger atteste que le dispositif médical répond aux normes de sécurité et de qualité nécessaires à sa vente en Colombie.
Déroulement du processus
Gestion du cycle de vie des appareils après leur approbation
Freyr aide les fabricants étrangers dans la gestion end-to-end du cycle de vie des dispositifs end-to-end , y compris les activités post-autorisation, telles que :
- Gestion des modifications après approbation - modifications des approbations de dispositifs médicaux existants, telles que l'ajout de nouvelles variantes, d'accessoires, l'ajout de nouvelles indications d'utilisation, etc.
- Maintien des agréments et de l'enregistrement par le paiement en temps voulu des frais administratifs et d'enregistrement
- Renouvellement des licences
- Liaison entre l'INVIMA et le fabricant
Résumé
| Classification des dispositifs médicaux | Nouvelles licences et renouvellements | ||
|---|---|---|---|
| Nouvelle inscription | Amendement | Renouvellement | |
| Classe I | 4-6 mois | 2-3 mois | 4-6 mois |
| Classe IIa | 4-6 mois | 2-3 mois | 4-6 mois |
| Classe IIb | 4-6 mois | 2-3 mois | 4-6 mois |
| Classe III | 4-6 mois | 2-3 mois | 4-6 mois |
| Frais d'inscription | |||||
|---|---|---|---|---|---|
| Nouvelles licences et renouvellements | Modifications techniques | Modifications administratives | |||
| Classe I et classe IIa | Classe IIb et classe III | Classe I et classe IIa | Classe IIb et classe III | Classe I et classe IIa | Classe IIb et classe III |
| $ 690,00 | $ 776,00 | $ 196,00 | $ 196,00 | $ 153,00 | $ 153,01 |
Expertise Freyr
- Diligence réglementaire
- Classification officielle
- Enregistrement de l'appareil
- Colombie Titulaire de l'enregistrement
- Aide à l'étiquetage
- Aide à la traduction
- Identification et qualification des distributeurs
- Surveillance post-marketing
- Gestion des changements après approbation
- Renouvellement et transfert de licence
- Soumission et liaison avec l'INVIMA