Aperçu de l'enregistrement des dispositifs médicaux en Égypte
Depuis septembre 2018, l'enregistrement des dispositifs médicaux est devenu obligatoire en Égypte. L'industrie des dispositifs médicaux dans le pays a connu une croissance constante, rendant le marché attrayant pour les fabricants et les distributeurs. Avec une évaluation de 4,0 milliards de dollars en 2021, le marché égyptien des dispositifs médicaux devrait atteindre un taux de croissance annuel composé (TCAC) de plus de 3% de 2022 à 2027. L'importation répond en grande partie à la demande de dispositifs médicaux en Égypte, étant donné la production locale relativement faible. Fait remarquable, le marché égyptien des dispositifs médicaux est le deuxième plus important de la région du Moyen-Orient et de l'Afrique du Nord (MENA). Cette vue d'ensemble explore les aspects clés du processus d'enregistrement égyptien, offrant un aperçu du cadre réglementaire et des exigences pour amener les dispositifs médicaux innovants au premier plan du secteur des soins de santé en Égypte.
Autorité de régulation : Autorité égyptienne des médicaments (EDA)
Réglementation : Loi égyptienne sur les dispositifs médicaux Loi n° 10 de 2003
Voie réglementaire : Enregistrement du produit (procédure normale et accélérée) et classification officielle
Égypte Représentant local autorisé : Titulaire de l'enregistrement égyptien (ERH)
Exigences du SMQ : ISO 13485
Évaluation des données techniques : Le Drug Policy and Planning Center (DPPC) et l'Administration centrale des affaires pharmaceutiques (CAPA).
Validité de la licence : Dix (10) ans
Format de soumission : Papier et électronique
Traduction : Documents traduits en arabe et en anglais
Classification des dispositifs
En Égypte, la classification des dispositifs médicaux s'aligne sur le système européen de classification, qui classe les dispositifs médicaux en fonction de l'usage auquel ils sont destinés et des risques potentiels associés à leur utilisation. Les fabricants doivent identifier la classification correcte de leurs dispositifs afin de garantir la conformité avec les exigences réglementaires et d'obtenir les autorisations nécessaires à la commercialisation et à la distribution en Égypte.
Classes de dispositifs médicaux
| Classe | Risque |
|---|---|
| Classe I | Faible |
| Classe II a | Faible-Moyen |
| Classe II b | Moyenne-élevée |
| Classe III | Haut |
Égypte Représentant local autorisé
Les entreprises de dispositifs médicaux basées en dehors de l'Égypte doivent désigner un agent local appelé "Egyptian Registration Holder (ERH)" pour s'occuper en leur nom de la soumission des demandes d'enregistrement et des dossiers à l'EDA. L'ERH assure la liaison entre le fabricant et l'autorité réglementaire, en veillant à la préparation et à la soumission de tous les documents requis et en vérifiant que le dispositif médical répond aux normes de sécurité, de qualité et d'efficacité de l'EDA. En outre, le titulaire de l'enregistrement est responsable de la conservation des documents d'enregistrement, du signalement des incidents ou des rappels, et du respect permanent de toutes les normes et réglementations applicables tout au long du cycle de vie du dispositif. Le titulaire égyptien de l'enregistrement (ERH) est entièrement responsable de l'enregistrement d'un dispositif médical auprès de l'EDA, en particulier au sein de l'administration centrale des dispositifs médicaux. Ce rôle consiste à s'assurer que le dispositif est conforme aux exigences réglementaires de l'EDA en matière de commercialisation et de distribution en Égypte.
Enregistrement des dispositifs médicaux
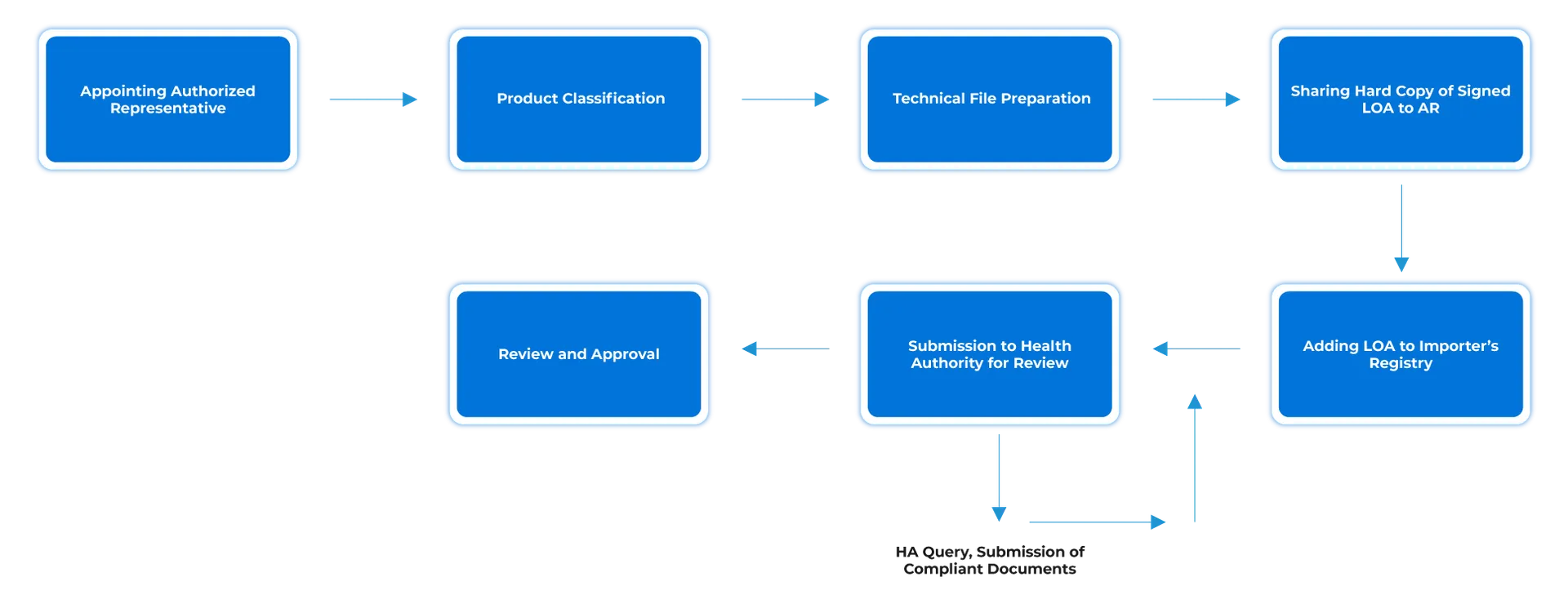
L'obtention d'une autorisation de mise sur le marché d'un dispositif médical en Égypte comprend plusieurs étapes, notamment la préparation de la documentation requise, la soumission de la demande à l'EDA, le respect des exigences en matière de classification et de système de qualité, la désignation d'un ERH si nécessaire, et le respect des obligations après la mise sur le marché. Le processus d'enregistrement est essentiel pour garantir que les dispositifs médicaux sont conformes aux normes de sécurité, de qualité et d'efficacité établies par l'autorité réglementaire égyptienne. La documentation requise peut varier en fonction de la voie d'enregistrement choisie, mais elle comprend généralement les éléments suivants :
- Certificat CE (le cas échéant).
- Certificat de vente libre (CFS).
- Certification ISO 13485 .
- Déclaration de conformité (DOC).
Déroulement du processus
Gestion du cycle de vie des appareils après leur homologation
Freyr apporte un soutien complet aux fabricants étrangers dans la gestion de l'ensemble du cycle de vie des dispositifs médicaux en Égypte, y compris les activités post-approbation :
- La gestion des modifications post-approbation, qui concerne les modifications apportées aux approbations de dispositifs médicaux existants, telles que l'ajout de nouvelles variantes, d'accessoires et d'indications d'utilisation.
- Mise à jour de la ISO 13485:2016.
- Certification CE.
- Agir en tant qu'intermédiaire entre l'organisme notifié (ON) et le fabricant.
- Un système de vigilance mis en place pour contrôler la sécurité du dispositif médical après l'obtention de l'autorisation de mise sur le marché.
- Fournir des mises à jour périodiques concernant la sécurité et l'efficacité du dispositif médical, ainsi que toute modification du statut réglementaire dans d'autres juridictions.
- Renouvellement de l'autorisation de mise sur le marché, en fonction du type de dispositif et de la réglementation, après une certaine période.
Une gestion efficace Post-market Surveillance (PMS) Égypte implique de savoir naviguer habilement dans les cadres réglementaires établis par l'EDA. Les nouveaux entrants sur le marché qui sont confrontés à ces complexités et qui ne disposent pas d'un partenaire réglementaire établi peuvent tirer parti des services réglementaires étendus proposés par Freyr. Ces services contribuent à un processus d'autorisation fluide pour les dispositifs médicaux en Égypte, garantissant une conformité continue avec le paysage réglementaire et la dynamique du marché en constante évolution.
Expertise en matière d'enregistrement des dispositifs médicaux en Égypte
- Veille réglementaire.
- Due Diligence réglementaire.
- Classification des dispositifs médicaux.
- Enregistrement de l'appareil.
- Titulaire égyptien de l'enregistrement.
- Soutien à la traduction.
- Rédaction médicale.
- Soutien à l'étiquetage.
- Identification et qualification des distributeurs.
- Gestion des changements après approbation.
- Renouvellement et transfert de licence.
- Dédouanement.
