Aperçu de l'enregistrement des dispositifs médicaux en Israël
L'industrie israélienne des dispositifs médicaux connaît une croissance et une innovation soutenues, ce qui en fait une plaque tournante pour les technologies de pointe dans le domaine de la santé. L'enregistrement des dispositifs médicaux est crucial pour les entreprises qui pénètrent sur ce marché dynamique. Cette vue d'ensemble explore les aspects clés du processus d'enregistrement en Israël, offrant un aperçu du cadre réglementaire et des exigences pour amener les dispositifs médicaux innovants au premier plan du secteur de la santé en Israël.
Autorité de régulation : Division des dispositifs médicaux du ministère israélien de la santé (AMAR).
Règlement : Loi de 2012 sur les dispositifs/équipements médicaux
Voie réglementaire : Enregistrement du produit
Israël Représentant local autorisé : Israël Titulaire de l'enregistrement (IRH)
Exigences du SMQ : ISO 13485
Évaluation des données techniques : Le service des dispositifs médicaux du ministère de la santé
Validité de la licence : Cinq (05) ans
Format de soumission : Papier et électronique
Traduction : Documents traduits en hébreu
Classification des dispositifs
La loi sur les équipements médicaux et les règlements relatifs à l'enregistrement des équipements médicaux en Israël ne prévoient pas de système de classification des risques. Au lieu de cela, Israël aligne sa classification des dispositifs médicaux sur les normes internationales, en particulier celles définies par les pays du Groupe de travail sur l'harmonisation mondiale (GHTF). Par ailleurs, la classification des risques d'un dispositif dans un pays reconnu est adoptée pour l'enregistrement en Israël. Ce processus de classification prend généralement en compte l'utilisation prévue, le niveau de risque et d'autres facteurs susceptibles d'avoir un impact sur la sécurité et l'efficacité des dispositifs médicaux.
Classes de dispositifs médicaux
| Classe | Risque |
|---|---|
| Classe I | Faible |
| Classe II | Faible-Moyen |
| Classe III | Haut |
Modifications proposées pour les voies d'enregistrement
Les modifications proposées s'appliquent aux dispositifs de classe I et de classe II, tandis que le système d'enregistrement des dispositifs de classe III reste inchangé.
- Les dispositifs de classe I peuvent être enregistrés immédiatement par autodéclaration.
- Pour les dispositifs de classe II, bien que les déclarations et les documents techniques soient nécessaires, l'AMAR peut accélérer le processus à quatorze (14) jours pour ceux jugés à faible ou moyen risque. Cela s'applique si le fabricant détient deux (02) autorisations de pays reconnus et fournit six (06) mois de données sur le marché. Par ailleurs, pour les dispositifs de classe II ne disposant que de l'autorisationFDA (k)FDA US et de six (06) mois de données US , le délai de traitement de l'AMAR est ramené à soixante (60) jours.
Israël Représentant local autorisé
Les entreprises de dispositifs médicaux basées en dehors d'Israël doivent désigner un titulaire d'enregistrement israélien (IRH) pour faciliter l'enregistrement de leurs produits en vue de leur vente dans le pays. L'IRH agit en tant que représentant local du fabricant et est chargé d'assurer la liaison avec le ministère de la santé afin de garantir le respect des réglementations locales. En outre, un IRH est chargé d'établir et de maintenir une présence commerciale en Israël, ainsi que d'obtenir et de maintenir une licence commerciale valide.
Enregistrement des dispositifs médicaux
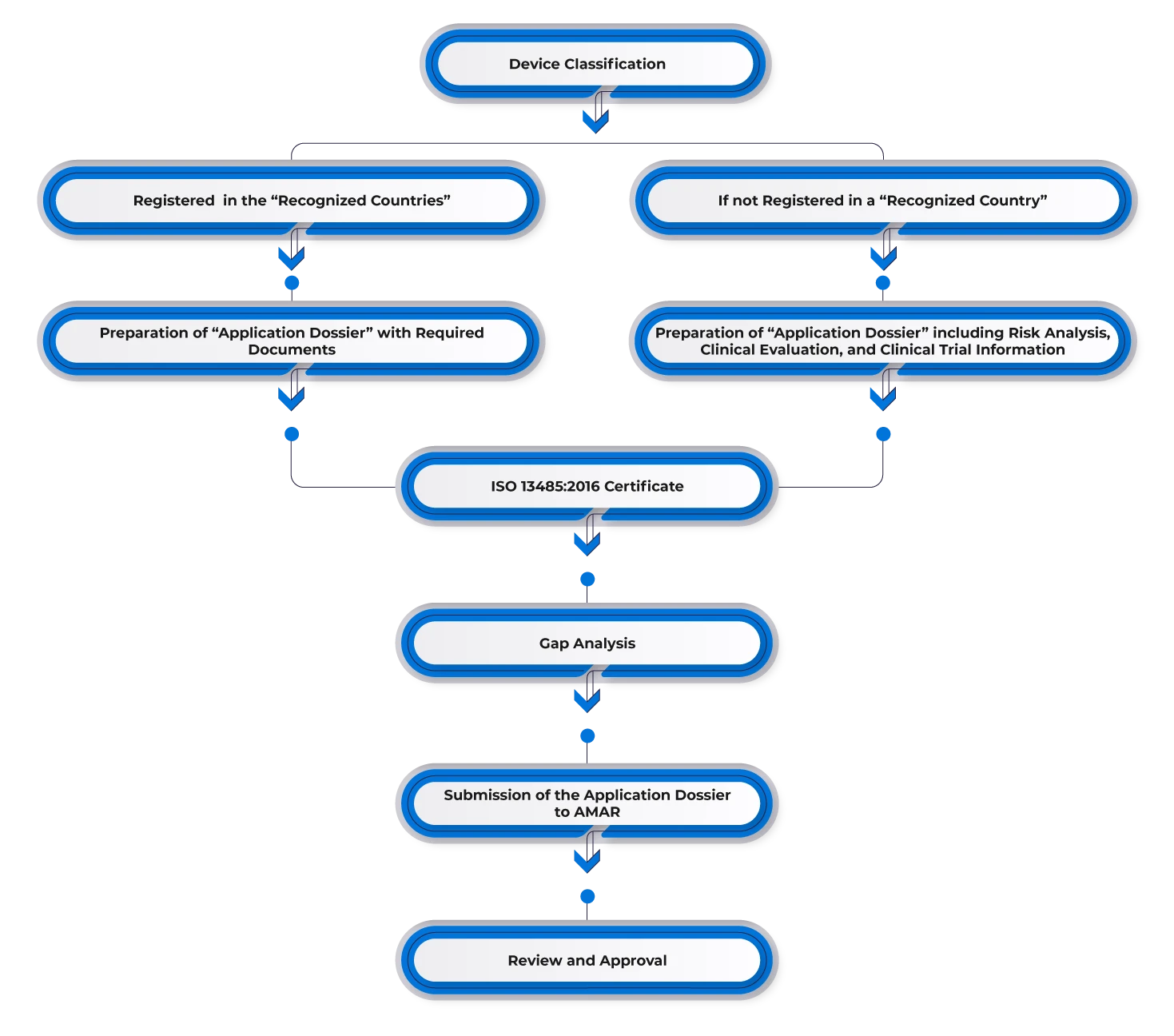
Pour enregistrer un dispositif médical en Israël, les fabricants doivent obtenir une autorisation préalable dans l'un des marchés de référence tels que les États-Unis, l'Europe, l'Australie, le Canada ou d'autres marchés importants. Les fabricants ayant obtenu une autorisation dans l'un des pays de référence peuvent l'utiliser pour le marché israélien et désigner un représentant dans le pays. Ils doivent ensuite soumettre la documentation requise, y compris :
- FDA 510(k)/Lettre d'approbation de mise sur le marché/CE.
- Certificat à un gouvernement étranger (CFG)/Certificat de vente libre (CFS).
- Certification ISO 13485 ou autre certification reconnue en matière de bonnes pratiques de fabrication (BPF).
- Validation et certification par l'Institut de normalisation d'Israël (si nécessaire).
Déroulement du processus
Gestion du cycle de vie des appareils après leur homologation
Freyr apporte un soutien complet aux fabricants étrangers dans la gestion de l'ensemble du cycle de vie des dispositifs médicaux en Israël, y compris les activités post-approbation :
- La gestion des modifications post-approbation, qui concerne les modifications apportées aux approbations de dispositifs médicaux existants, telles que l'ajout de nouvelles variantes, d'accessoires et d'indications d'utilisation.
- Maintien de la certification ISO 13485:2016 et CE.
- Renouvellement des licences.
- Agir en tant qu'intermédiaire entre l'organisme notifié (ON) et le fabricant.
Il peut être difficile de s'y retrouver parmi les subtilités des organismes d'autorisation et de se conformer aux multiples réglementations relatives à l'homologation des dispositifs. L'obtention des homologations dans les différents pays du GHTF et le respect des réglementations nationales exigent une connaissance approfondie de la réglementation. Pour les nouveaux acteurs du marché confrontés à ces complexités sans partenaire réglementaire établi, Freyr propose des services end-to-end , rationalisant le processus d'homologation des dispositifs médicaux en Israël.
Expertise en matière d'enregistrement des dispositifs médicaux en Égypte
- Classification des dispositifs médicaux en Israël.
- Titulaire de l'enregistrement d'Israël (IRH).
- Israël Enregistrement de l'appareil.
- ISO 14971:2019 Consultation sur la gestion des risques.
- Conformité à la ISO 13485:2016.
- Examen, compilation et soumission du dossier de conception.
- Enregistrement des dispositifs médicaux via le système d'enregistrement en ligne.
- Rapport sur la stratégie réglementaire en matière de dispositifs médicaux.
- Soutien aux essais - biocompatibilité, sécurité électrique, mécanique et performance.
- Conformité du labelling .
- Soutien des BPF.
- Post-market Surveillance (PMS) .
