Services de réglementation des dispositifs médicaux
à Singapour Vue d'ensemble
À Singapour, les dispositifs médicaux sont régis par la loi sur les produits de santé (Health Products Act, HPA) et son règlement sur les produits de santé (dispositifs médicaux) (Health Product (Medical Devices) Regulations 2010).
Autorité de régulation : Autorité des sciences de la santéHSA
Règlement : Règlement de 2010 sur les produits de santé (dispositifs médicaux)
Voie réglementaire : Direction des dispositifs médicaux de l'Autorité des sciences de la santéHSA
Représentant autorisé : Singapour Titulaire
Exigence du SMQ : SS 620:2016, Singapore Standard for Good Distribution Practice for Medical Devices, et ISO 13485:2016
Évaluation des données techniques : Autorité des sciences de la santéHSA
Validité de la licence : Toutes les licences de concessionnaires sont valables 12 mois à compter de la date d'approbation.
Labelling : Guide réglementaire, GN- 23 Révisé (1er mars 2020)
Format de soumission : En ligne
Langue : Anglais
Classification des dispositifs médicaux HSA
HSA applique 16 séries de règles pour classer les dispositifs médicaux, du risque le plus faible au risque le plus élevé, dans les classes A, B, C et D.
La classification des risques dépend de facteurs tels que la durée du contact, le degré d'invasivité, l'utilisation prévue et la méthode d'administration.
Classification des dispositifs médicaux, HSA
| Classe de risque | Niveau de risque | Exemples de dispositifs médicaux |
|---|---|---|
| Classe A | Risque faible | Visionneuse de film, main chirurgicale, gaine, masque à oxygène |
| Classe B | Risque faible à modéré | Brassard de pression artérielle, stérilisateur de tige |
| Classe C | Risque modéré à élevé | Moniteur patient, mesin X-ray |
| Classe D | Risque élevé | Stents cardiaques, stimulateurs cardiaques |
Classification des DIV
Les dispositifs médicaux in vitro sont classés ci-dessous du risque le plus faible au risque le plus élevé.
Classe de risque | Niveau de risque | Exemples de dispositifs médicaux in vitro |
|---|---|---|
| Classe A | Faible risque individuel et faible risque pour la santé publique | Récipient à spécimen |
| Classe B | Risque individuel modéré ou faible risque pour la santé publique ou les deux | Vitamine B12, autotest de grossesse, anticorps antinucléaires, bandelettes urinaires |
| Classe C | Risque individuel élevé ou risque modéré pour la santé publique ou les deux | Autocontrôle de la glycémie, typage HLA, dépistage du PSA , IgM contre la rubéole |
| Classe D | Risque individuel élevé et risque élevé pour la santé publique | Dépistage du VIH chez les donneurs de sang, kit de diagnostic du VIH |
Singapore Medical Device Authorized Representative / Registrant
Le déclarant est le lien entre votre entreprise et la HSA, who s'occupe de l'enregistrement des dispositifs à Singapour. Le représentant autorisé des dispositifs médicaux de Singapour traite la demande d'enregistrement auprès de la HSA et possède votre enregistrement de dispositif HSA . Seules les sociétés ou entités basées à Singapour peuvent agir en tant que déclarant ; elles doivent également être enregistrées auprès de la HSA.
Enregistrement des dispositifs médicaux HSA
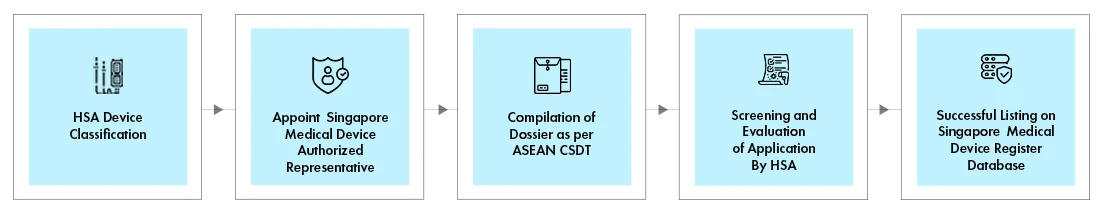
Le processus d'enregistrement des dispositifs médicaux HSA s'effectue par l'intermédiaire du système d'information et de communication sur les dispositifs médicaux (MEDICS) en ligne de la HSA . Chaque enregistrement de dispositif HSA se fait par une voie d'évaluation spécifique, en fonction des éléments suivants :
- Classification des risques du dispositif.
- Nombre d'autorisations préalables données par les agences réglementaires de référence à l'étranger.
- Durée de l'historique de la commercialisation du dispositif en matière de sécurité.
L'itinéraire d'évaluation de l'appareil déterminera le délai d'exécution (TAT), les frais et les documents requis pour l'enregistrement.
Enregistrement de la classe A - Les dispositifs médicaux de la classe A sont exemptés de l'enregistrement des produits. Cependant, il est nécessaire de compléter la liste d'exemption de la classe A dans MEDICS lors de la demande de licence du distributeur.
Déroulement du processus
Gestion du cycle de vie des appareils après leur approbation
Freyr les fabricants étrangers dans la gestion end-to-end du cycle de vie des dispositifs end-to-end , y compris les activités post-autorisation, telles que :
- Gestion des modifications post-approbation - modifications apportées aux approbations de dispositifs médicaux existants, telles que l'ajout de nouvelles variantes et d'accessoires, l'ajout de nouvelles indications d'utilisation, entre autres.
- Maintien de l'homologation et de l'enregistrement des dispositifs médicaux grâce au paiement en temps voulu des frais administratifs et d'enregistrement.
- Renouvellement de la licence.
Grâce à une équipe professionnelle chargée de l'assistance réglementaire, Freyr aide les fabricants à maintenir la qualité et la sécurité nécessaires à l'homologation de leurs produits. Les experts de Freyrobservent attentivement les mises à jour réglementaires et informent les clients des mesures à prendre pour que les produits soient conformes aux normes en vigueur.
Résumé
Les délais d'enregistrement des produits sont indiqués dans le tableau suivant.
| Classe de risque | Immédiate | Accéléré | Abrégé | Évaluation complète | Complet (système d'évaluation des priorités) |
|---|---|---|---|---|---|
| Classe B | Enregistrement immédiat dès la soumission | 100 jours ouvrables | 160 jours ouvrables | 120 jours ouvrables | |
| Classe C | Enregistrement immédiat dès la soumission (uniquement pour les applications mobiles médicales autonomes de classe C) | 120 jours ouvrables | 160 jours ouvrables | 220 jours ouvrables | 165 jours ouvrables |
| Classe D | 180 jours ouvrables | 220 jours ouvrables | 310 jours ouvrables | 235 jours ouvrables | |
| Classe D (dispositifs intégrant Produits médicaux) | 220 jours ouvrables | 310 jours ouvrables |
Le délai de traitement d'un changement de titulaire est de 40 jours ouvrables.
NOTE-
- Les dispositifs médicaux de classe A sont exemptés de l'enregistrement des produits.
- Le délai d'exécution exclut le temps nécessaire pour répondre à toute demande de clarification ou d'information supplémentaire de la part de HSA au cours de la phase d'évaluation.
Expertise Freyr
- Due Diligence réglementaire pour l'enregistrement des dispositifs auprès de la HSA, Singapour
- Classification et regroupement des dispositifs médicaux HSA
- Soutien à l'évaluation de l'organisme d'évaluation de la conformité (OEC)
- Modèle de dossier de soumission commun de l'ANASE (CSDT) Compilation des dossiers
- Enregistrement de l'appareil HSA ;
- Représentation juridique
- Soutien à l'étiquetage
- Identification et qualification des distributeurs
- Surveillance post-commercialisation
- Gestion des changements après l'approbation
- Renouvellement et transfert de licence
- Services de soumission et de liaison avec la HSA