Aperçu de l'enregistrement des dispositifs médicaux en Nouvelle-Zélande
En Nouvelle-Zélande, les dispositifs médicaux sont réglementés par la New Zealand Medicines and Medical Devices Safety Authority (Medsafe) conformément aux Medicines Regulations 1984, à la Medicines Act 1981 et aux Medicines (Database of Medical Devices) Regulations 2003. Bien que l'approbation préalable à la mise sur le marché ne soit pas nécessaire, l'inscription des produits dans la base de données du système WAND (Electronic Web Assisted Notification of Devices) dans les 30 jours suivant le lancement commercial est indispensable. Medsafe peut demander des documents prouvant la sécurité et l'efficacité des produits, tels que la certification d'organismes reconnus comme un organisme notifié de l'UE ou de Health Canada.
L'équipe d'experts en réglementation des dispositifs médicaux de Freyr possède une expérience considérable dans l'accompagnement des entreprises de dispositifs médicaux tout au long du processus d'enregistrement Medsafe pour les dispositifs médicaux en Nouvelle-Zélande.

Autorité de régulation : Autorité de sécurité des dispositifs médicaux (Medsafe)
Règlement :The Medicines (Database of Medical Devices) Regulations, 2003
Medicines Act 1981
Medicines Regulation 1984
Voie réglementaire : Système électronique de notification des dispositifs assistés par le web (WAND)
Représentant autorisé : Dispositif médical Sponsor
Exigence du SMQ : Certification ISO 13485:2016
Évaluation des données techniques : Autorité de sécurité des dispositifs médicaux (Medsafe)
Validité de la licence : Les listes de dispositifs en Nouvelle-Zélande n'expirent pas. Les dispositifs jugés dangereux pour le public peuvent être retirés du marché.
Exigences en matière d'étiquetage : Règlement 12(4) de la réglementation sur les médicaments de 1984 et GHTF/SG1/N43:2005
Format de soumission : Système électronique de notification des dispositifs assistés par le web (WAND)
Langue : Anglais
Classification des dispositifs médicaux en Nouvelle-Zélande
En Nouvelle-Zélande, les dispositifs médicaux sont classés par risque en classes I, IIa, IIb, III et AIMD, conformément aux critères de l'International Medical Device Regulators Forum (IMDRF). Cette classification influe sur le niveau de contrôle réglementaire nécessaire. La classification est basée sur des caractéristiques telles que la finalité du dispositif, la durée du contact avec le corps, le caractère invasif et le fait qu'il soit actif ou inactif. Les gadgets de classe supérieure font l'objet d'une surveillance réglementaire plus stricte. Medsafe est l'organisme de réglementation néo-zélandais qui supervise ces classifications et réglementations.
| Classification Medsafe des dispositifs médicaux autres que les DIV Classe | Risque |
|---|---|
| Classe I de base | Risque faible |
| Mesure de la classe I | Risque faible |
| Classe I stérile | Risque faible |
| Classe IIa | Risque faible à moyen |
| Classe IIb | Risque moyen à élevé |
| Classe III et Dispositif médical implantable actif (DMIA) | Risque élevé |
| Classification Medsafe IVD | Risque |
|---|---|
| Depuis juillet 2014, Medsafe ne reconnaît aucun système de classification des risques pour les DIV. Tous les DIV notifiés à WAND doivent utiliser le code de classification des risques du DIV. Le directeur général de la santé a autorisé l'exemption pour les DIV conformément à l'annexe 1, paragraphe (i) des Medicines (Database of Medical Devices) Regulations 2003. Mais les fournisseurs de DIV peuvent volontairement notifier leurs dispositifs à la base de données. | |
Représentant autorisé/parrain d'un dispositif médical
Le représentant agréé est appelé le sponsor et agit en tant qu'intermédiaire entre le fabricant et Medsafe. Les promoteurs sont les représentants réglementaires des produits commercialisés en Nouvelle-Zélande. Ils soumettent les demandes d'autorisation de mise sur le marché (WAND) et constituent le principal point de contact entre le fabricant et Medsafe pour toutes les questions relatives au produit. En outre, Medsafe tient le sponsor pour responsable des efforts de vigilance.
Enregistrement des dispositifs médicaux en Nouvelle-Zélande
L'enregistrement des dispositifs médicaux, la procédure néo-zélandaise et la procédure d'inscription sur la liste WAND en Nouvelle-Zélande varient en fonction de la classe du dispositif.
Dispositifs de classe I - Une déclaration de conformité du fabricant est requise pour les équipements non stériles et non mesurables de classe I. Cependant, elle est rarement déposée auprès d'un organisme de réglementation. Au lieu de cela, le promoteur (ou le fournisseur) doit entrer les détails du dispositif dans la base de données Web Assisted Notification of Devices (WAND) dans le cadre du processus de notification Medsafe.
Autres dispositifs de classe
En Nouvelle-Zélande, les promoteurs ou les fournisseurs sont chargés de veiller à ce que les dispositifs médicaux soient conformes à des normes telles que la ISO 13485:2016. La soumission directe d'une déclaration de conformité, d'une certification QMS ou de preuves de fabrication à Medsafe n'est généralement pas requise. Cependant, la conservation de cette documentation est essentielle pour prouver la conformité sur demande.
Medsafe donne la priorité à la surveillance post-commercialisation plutôt qu'à l'approbation détaillée des dispositifs médicaux avant leur mise sur le marché. Bien que les audits ne soient pas systématiquement menés pendant la phase de notification, Medsafe peut les entreprendre pour les dispositifs à haut risque ou à la suite d'activités de vigilance et de rapports d'événements indésirables, afin de garantir une sécurité et une conformité continues.
Une fois qu'un dispositif est notifié via la base de données WAND, il peut être commercialisé en Nouvelle-Zélande, à condition que le fournisseur respecte systématiquement les réglementations de Medsafe. Cela exige une conformité permanente, en particulier en ce qui concerne les normes de surveillance post-commercialisation et de signalement des incidents. Les experts en dispositifs médicaux de Freyr proposent des services liés à la navigation dans ces exigences réglementaires, en veillant à ce que les entreprises maintiennent la conformité tout au long du cycle de vie du produit.
Déroulement du processus
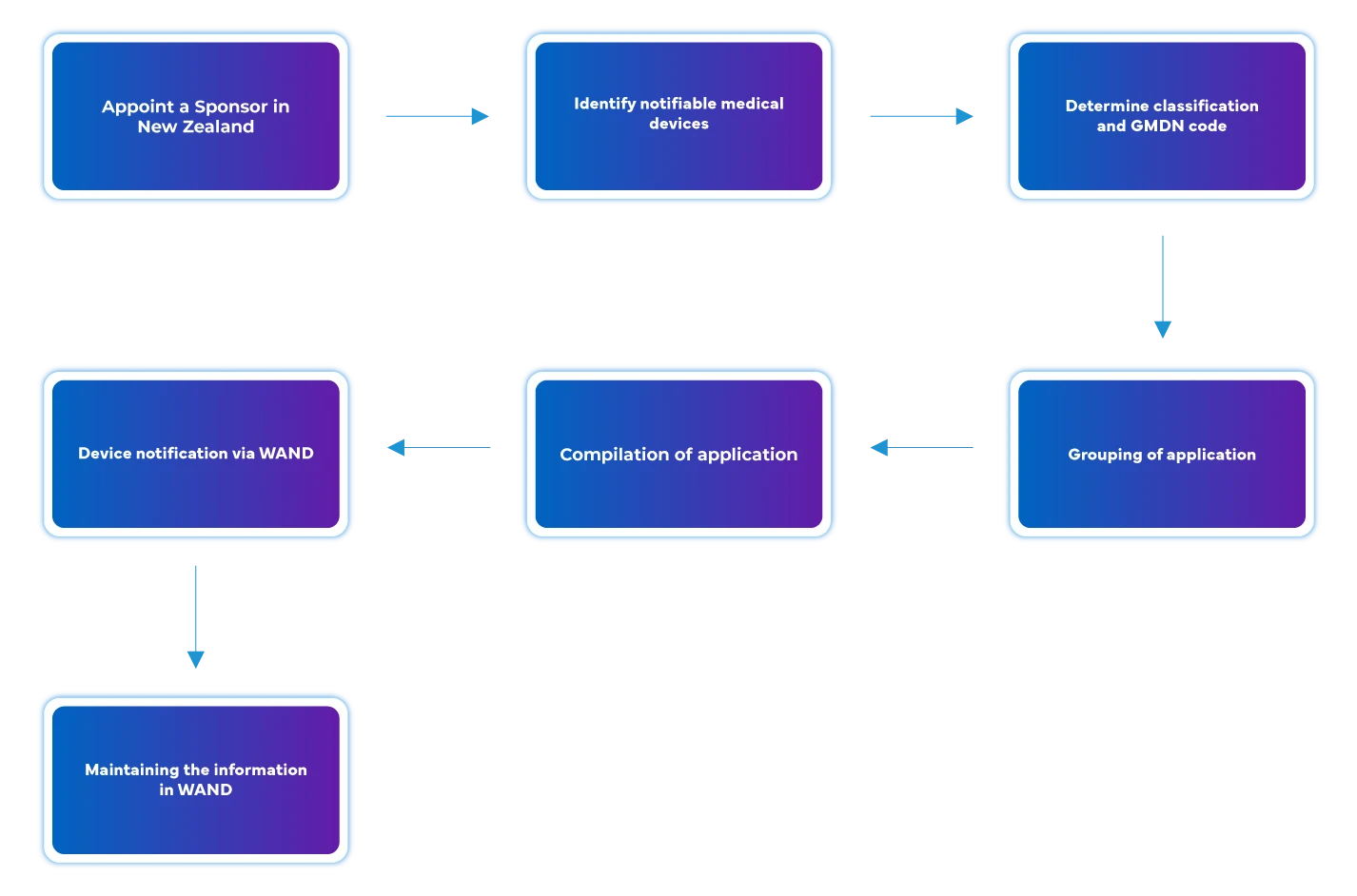
Gestion du cycle de vie des appareils après leur approbation
Freyr aide les fabricants étrangers dans la gestion end-to-end du cycle de vie des dispositifs end-to-end , y compris les activités post-autorisation, en informant les autorités néo-zélandaises via WAND, par exemple :
- Gestion des modifications après approbation - modifications des approbations de dispositifs médicaux existantes, telles que l'ajout de nouvelles variantes, d'accessoires, l'ajout de nouvelles indications d'utilisation, etc.
- Maintien des agréments et de l'enregistrement.
Doté d'une équipe de professionnels de la réglementation, Freyr offre un soutien complet aux fabricants afin qu'ils respectent les normes de qualité et de sécurité requises pour l'autorisation de mise sur le marché. Les spécialistes de l'intelligence réglementaire de l'entreprise suivent méticuleusement les mises à jour des réglementations, garantissant que les clients sont bien informés des actions nécessaires pour maintenir la conformité de leurs produits avec les normes en vigueur.
Résumé
| Risque | Classe d'appareil | Audit du SMQ | Voie réglementaire | Délais Medsafe | Validité de l'enregistrement (années) |
|---|---|---|---|---|---|
| Risque faible | Classe I de base | Conformité à la ISO 13485:2016 Note - Medsafe n'exige pas d'audits QMS mais recommande fortement de suivre la ISO 13485:2016 pour la qualité et la sécurité. Medsafe est habilité à effectuer des audits QMS pour toute classe de dispositifs en cas de problèmes de sécurité ou de qualité. | Inscription sur la liste WAND (notification) | 1 semaine |
Pas de date d'expiration |
| Risque faible | Mesure de la classe I | Inscription sur la liste WAND (notification) | |||
| Risque faible | Classe I stérile | Inscription sur la liste WAND (notification) | |||
| Risque faible à moyen | Classe IIa | Inscription sur la liste WAND (notification) | |||
| Risque moyen à élevé | Classe IIb | Inscription sur la liste WAND (notification) | |||
| Risque élevé | Classe III | Inscription sur la liste WAND (notification) |
Remarque : selon la législation actuelle, les listes de dispositifs en Nouvelle-Zélande n'expirent pas, mais les dispositifs considérés comme présentant un risque inacceptable pour le public peuvent être retirés du marché. Toutefois, la législation actuelle pourrait être révisée d'ici 2026/2027.
Expertise Freyr
- Soutien de bout en bout à l'enregistrement des dispositifs médicaux.
- Soutien au LR
- Liste WAND
- Aide à l'étiquetage
- Gestion des changements après approbation
- Transfert de licence
- Services de soumission et de liaison avec la WAND
