Aperçu de la surveillance après la mise sur le marché
Post-market surveillance (PMS) essentielle pour les fabricants de dispositifs médicaux et les autres entreprises impliquées dans la distribution de dispositifs afin de garantir la sécurité des patients, la conformité réglementaire des dispositifs médicaux, l'amélioration continue des produits et de veiller à ce que les dispositifs médicaux restent sûrs, efficaces et conformes après leur mise sur le marché.
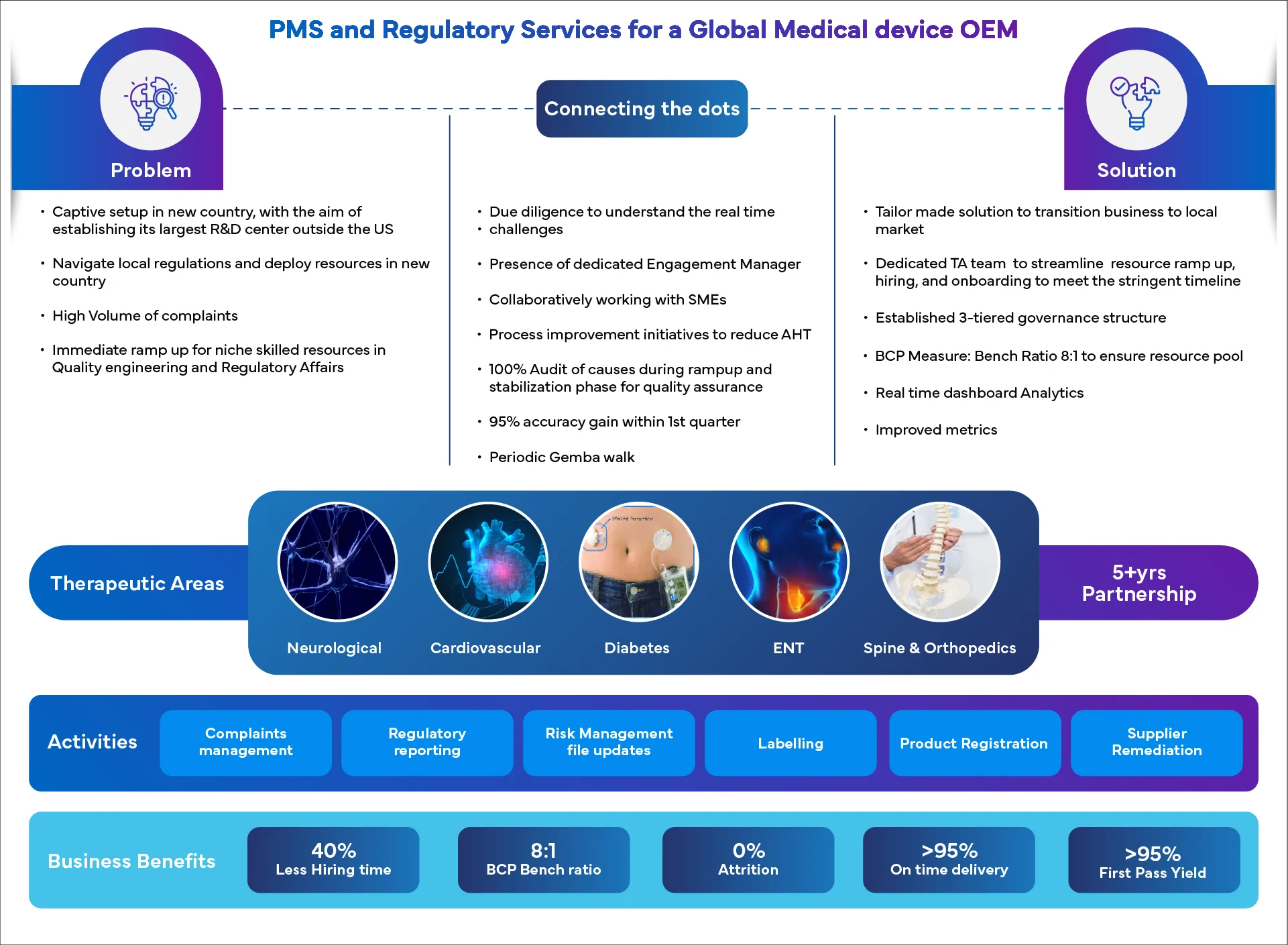
Les consultants en surveillance post-commercialisation de Freyraident les fabricants de dispositifs médicaux à s'y retrouver dans la complexité des réglementations relatives à la surveillance post-commercialisation, y compris les exigences de EU MDR matière de surveillance post-commercialisation et le traitement des plaintes relatives aux dispositifs médicaux FDA .
Services de surveillance après la mise sur le marché
Produits Gestion des plaintes
Gestion End-to-end , de leur réception à leur signalement et à leur clôture, garantissant un traitement efficace, efficient et rapide des plaintes dans le cadre de processus PMS robustes pour les dispositifs médicaux.Gestion des rappels et des retours d'appareils
Notre équipe d'experts vous aidera à vous y retrouver dans les réglementations complexes liées aux rappels de dispositifs médicaux et aux actions de sécurité sur le terrain, en veillant à la conformité, à l'efficacité et à un minimum de perturbations.Corrections et déménagements
Notre équipe vous aidera à évaluer les risques, à communiquer avec les autorités réglementaires et les clients et à garantir la conformité de la documentation.PMSP, PMSR, PMCF, PSUR, Maintenance annuelle
Assistance complète pour la création, la mise à jour et le maintien de la documentation PMS, y compris les plans PMS, les rapports PMS, les services PMCF, les PSUR et les mises à jour réglementaires annuelles par le biais d'une surveillance post-commercialisation experte pour les dispositifs médicaux.Centre de contact multicanal et multilingue
Nos filiales locales spécialisées dans de nombreux pays à travers le monde permettront une assistance rentable et opportune, améliorant ainsi le service à la clientèle.Demande de renseignements médicaux et réponse
En tant qu'interface entre le titulaire de l'AMM et le patient ou le consommateur, notre équipe garantit des réponses cohérentes et contrôlées aux demandes de renseignements, ce qui constitue une partie essentielle de la surveillance après la mise sur le marché.Évaluation des risques pour la santé
Nous réalisons des évaluations scientifiques fondées sur des données probantes afin d'évaluer la gravité et la probabilité des dommages résultant des problèmes liés aux produits, ce qui constitue la base de la communication réglementaire et de la prise de décision en matière de rappels ou d'ACSE.Service de traduction des dispositifs médicaux
Traduction précise et conforme à la réglementation de toute la documentation relative au PMS, y compris les réclamations, les communications avec les clients, les FSN, les informations sur les patients, les IFU, les étiquettes et les rapports réglementaires, effectuée par des locuteurs natifs possédant une expertise dans le domaine.
Les services de surveillance post-marché de Freyr
Célébrer la réussite des clients
Pourquoi s'associer à Freyr?









