SaMD ) aux US Aperçu général
Réponse sur cette page
- Mon logiciel est-il un SaMD?
- Quelle classe de risque de SaMD nécessite un 510(k) ?
- Enregistrement et conformité SaMD - le processus 510(k)
- Quelle est la durée de validité de l'autorisation ?
Mon logiciel est-il un SaMD?
Selon l'International Medical Device Regulators Forum (IMDRF), le SaMD est un :
- Logiciel destiné à être utilisé à une ou plusieurs fins médicales.
- Il remplit ces fonctions sans faire partie d'un dispositif médical matériel.
Quelle classe de risque de SaMD nécessite un 510(k) ?
Déterminer la SaMD de votre logiciel est une étape importante du processus d'enregistrement. Une fois que votre logiciel a été classé comme SaMD, il est essentiel de comprendre le parcours réglementaire nécessaire pour entrer sur le marché US. SaMD généralement classés en différentes catégories, en fonction de leur niveau de risque. SaMD de classe II SaMD considérés comme SaMD un risque modéré, nécessitent une autorisation 510(k) et doivent prouver leur équivalence substantielle avec le dispositif de référence commercialisé légalement. Le processus d'autorisation garantit que votre SaMD substantiellement équivalent aux dispositifs existants, ce qui permet d'assurer sa sécurité et son efficacité avant sa commercialisation.
Enregistrement et conformité SaMD - le processus 510(k)
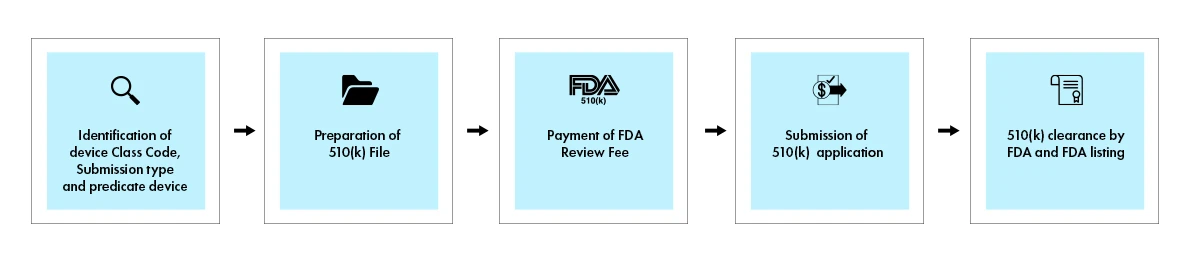
Le processus 510(k) implique la soumission d'un dossier complet démontrant l'équivalence substantielle avec un dispositif de référence commercialisé légalement. Une fois la décision prise, la US and Drug Administration (FDA) US envoie une lettre de décision au demandeur par e-mail. Une demande 510(k) qui reçoit une lettre de décision d'équivalence substantielle est considérée comme « approuvée ». Elle est ensuite répertoriée dans la base de données 510(k), avec le résumé 510(k) joint. La figure ci-dessous présente un aperçu visuel des principales étapes du processus 510(k).
Quelle est la durée de validité de l'autorisation ?
Une autorisation 510(k) reste valide jusqu'à ce que des modifications importantes soient apportées au dispositif ou à la réglementation applicable. Cependant, il est important de noter que laFDA US FDA demander des rapports périodiques ou des informations supplémentaires afin de garantir la conformité et la sécurité continues.
En conclusion, l'enregistrement SaMD nécessite une compréhension approfondie de la classification SaMD , de la conformité SaMD et des processus réglementaires. Le recours à des services de conseil en SaMD peut permettre de bénéficier de conseils d'experts pour naviguer dans les méandres de la complexité et garantir la réussite de l'enregistrement.
SaMD ) aux US
- StratégieFDA complèteFDA US pour SaMD.
- Classification SaMD .
- Identification du dispositif prédicat.
- Établir l'équivalence en substance avec le dispositif prédicat.
- Analyse des écarts pourFDA deFDA US .
- Compilation du dossier technique 510(k), conformément aux directivesFDA US relatives aux soumissions préalables à la mise sur le marché pour les logiciels.
- Création du modèle eCopy/eSTAR.
- Validation et soumission du modèle eCopy/eSTAR.
- Assurer la liaison avec les services pour l'approbation des dispositifs.
- Soutien à la réponse du RTA et aux déficiences de l'AINN.
- Services de consultation pour remédier aux déficiences.
- Enregistrement de l'établissement auprès de laFDA US .
- Liste des appareils et maintenance de la base de données FURLS.
- Services de représentants légaux (RL).

- Expérience approfondie de divers enregistrements 510(k).
- Expertise en matière de compilation 510(k), conformément aux exigences de la notification préalable à la mise sur le marché (510[k])FDA US
- Soutien supplémentaire pour le traitement des demandes 510(k).
- Soumission des produits dans les délais impartis.
- À jour avec les nouvelles modificationsFDA US concernant SaMD.