Aperçu de l'enregistrement des Software as a Medical Device SaMD
Les logiciels utilisés comme dispositifs médicaux (SaMD), également appelés logiciels pour dispositifs médicaux (MDSW), sont le dernier sujet en vogue dans le secteur des soins de santé. SaMD mondial SaMD devrait atteindre une valeurestiméeà US ,5 milliards US d'ici 2027, avec un TCAC de 21,9 % entre 2020 et 2027. Cette croissance est due à divers facteurs liés à SaMD , tels que l'adoption de l'Internet des objets (IoT), les plateformes de santé numériques et l'adoption de logiciels permettant la surveillance continue des paramètres physiologiques par les prestataires de soins de santé à des fins d'assistance à distance. Cette tendance a été encore accélérée par la pandémie de COVID, qui a rendu nécessaires les services de santé à distance et a ainsi créé le besoin d'un processus rationalisé d'enregistrement des logiciels en tant que dispositifs médicaux (SaMD). Il existe trois types de logiciels liés aux dispositifs médicaux basés sur la classification des logiciels en tant que dispositifs médicaux (SaMD), à savoir :
- Logiciel dans un dispositif médical (SiMD)
- Logiciels en tant que dispositifs médicauxSaMD
- Logiciel utilisé pour la fabrication/maintenance d'un dispositif médical
Scénario réglementaire mondial
En ce qui concerne les SaMD, différents types sont utilisés pour diverses applications telles que le dépistage et le diagnostic, la surveillance et l'alerte, la gestion des maladies, etc. Les agences sanitaires des pays développés ou hautement réglementés tels que l'UE, les US, le Canada et l'Australie ont défini des réglementations relatives aux SaMD et certaines d'entre elles ont déjà élaboré des documents d'orientation, tandis que d'autres sont en cours d'élaboration. Certains marchés semi-réglementés et non réglementés considèrent ces logiciels comme des dispositifs médicaux, mais ne disposent pas de lignes directrices différenciées et spécifiques pour la classification des logiciels utilisés comme dispositifs médicaux (SaMD). Ils suivent les lignes directrices harmonisées internationalement reconnues pour l'évaluation et l'approbation des logiciels. Vous trouverez ci-dessous quelques-unes des principales lignes directrices disponibles sur les SaMD :
- Orientations de l'IMDRF pour la classification, le système de gestion de la qualité, l'évaluation de la cybersécurité et l'évaluation clinique
- LEU MDR contient des informations détaillées sur cette catégorie de dispositifs.
- Orientations du MDCG sur la qualification et la classification des SaMD, exigences CER / PER pour les SaMD
- FDA US sur la cybersécurité, l'évaluation clinique et les exigences d'enregistrement pour différents types de logiciels tels que les systèmes décisionnels, les PACS, les applications mobiles, etc.
- Document d'orientation de Health Canada sur la définition et la classification
- Les nouvelles réglementations de la TGA pour les dispositifs médicaux basés sur des logiciels, qui entreront en vigueur à partir d'août 2020
L'enregistrement des SaMD sur d'autres marchés mondiaux sera traité au cas par cas et nécessitera une interaction étroite avec l'agence de santé concernée pour l'approbation. La voie générale suivie pour l'enregistrement des SaMD est la suivante :
- Déterminer si un logiciel donné peut être considéré comme un SaMD
- Classification des dispositifs en fonction du risque encouru
- Identifier les normes applicables et les exigences en matière de données de l'agence de santé concernée
- Générer les données requises par l'agence concernée
- Constitution d'un dossier technique conformément aux exigences du pays
- Soumission et résolution des questions jusqu'à l'approbation
- Gestion du cycle de vie post-approbation
Assistance End-to-End Freyrpour les logiciels médicaux ( SaMD)
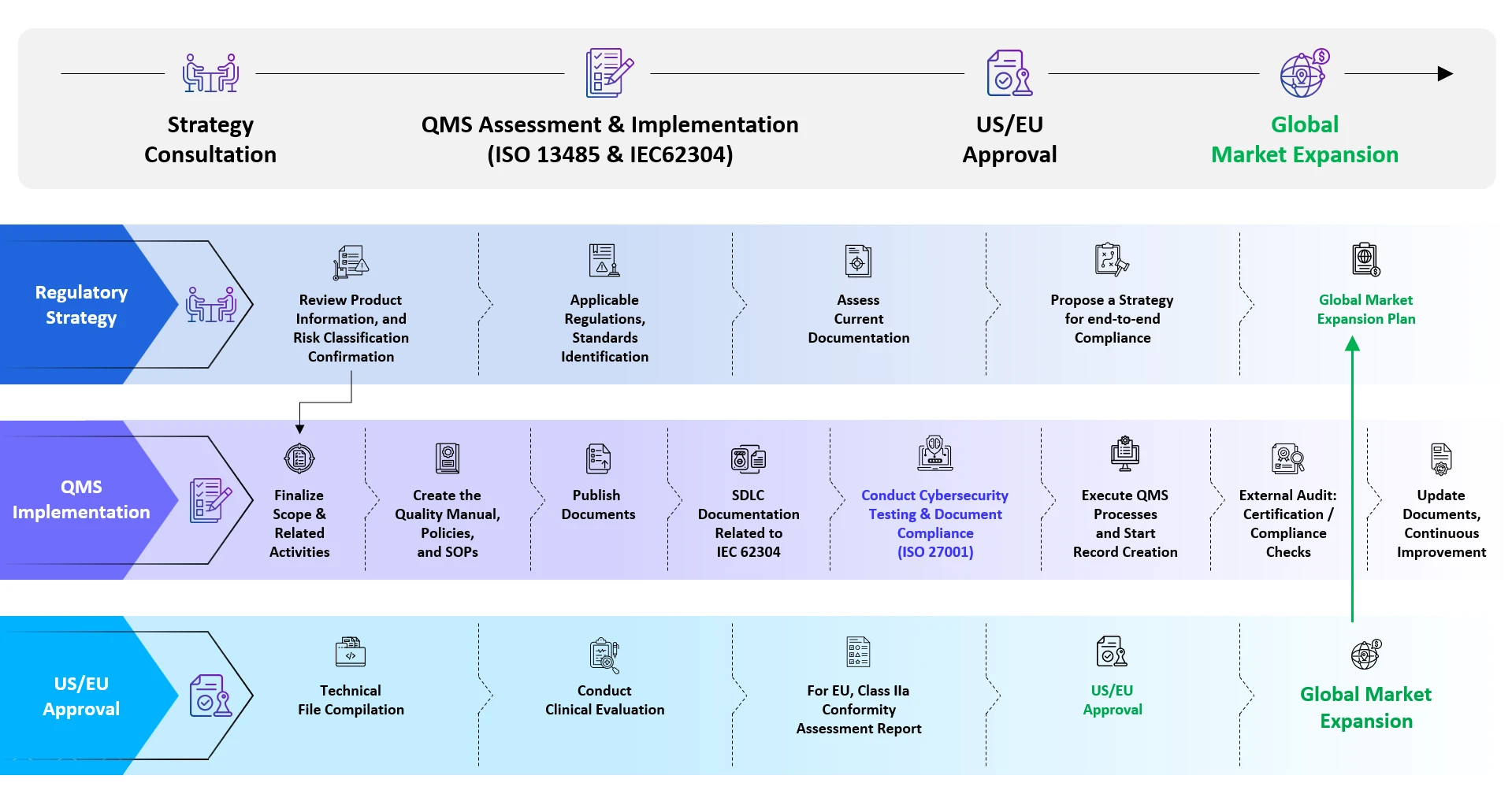
Services d'enregistrement des Software as a Medical Device SaMD
Enregistrement des Software as a Medical Device SaMD- Expertise
- Regulatory Intelligence Services
- Due Diligence réglementaire / Rapports stratégiques
- Qualification et classification des SaMD
- Identification des normes applicables
- Analyse des lacunes des documents sources
- Inscription au SaMD
- Conformité du Quality Management System (QMS)
- Services de consultation pour l'évaluation de la cybersécurité
- Services de consultation sur les études d'évaluation clinique
- Compilation des rapports d'évaluation clinique (CER) / rapports d'évaluation des produits (PER), etc.
- Gestion des changements après l'approbation





