
Aperçu de l'enregistrement des dispositifs médicaux au Vietnam
Le marché vietnamien des dispositifs médicaux est en plein essor et constitue actuellement l'un des secteurs les plus dynamiques du pays. Dans le pays, les dispositifs médicaux sont réglementés par le Department of Medical Equipment and Health Works (DMEHW), qui dépend du ministère de la santé. Les fabricants étrangers doivent désigner un représentant local autorisé pour les assister dans la procédure d'enregistrement des dispositifs médicaux au Viêt Nam.
Autorité de régulation : Département des équipements médicaux et des travaux de santé (DMEHW)
Règlement : Décret n°. 98/2021/ CP
Représentant autorisé : Représentant local autorisé du Vietnam
Exigence du SMQ : ISO 13485:2016
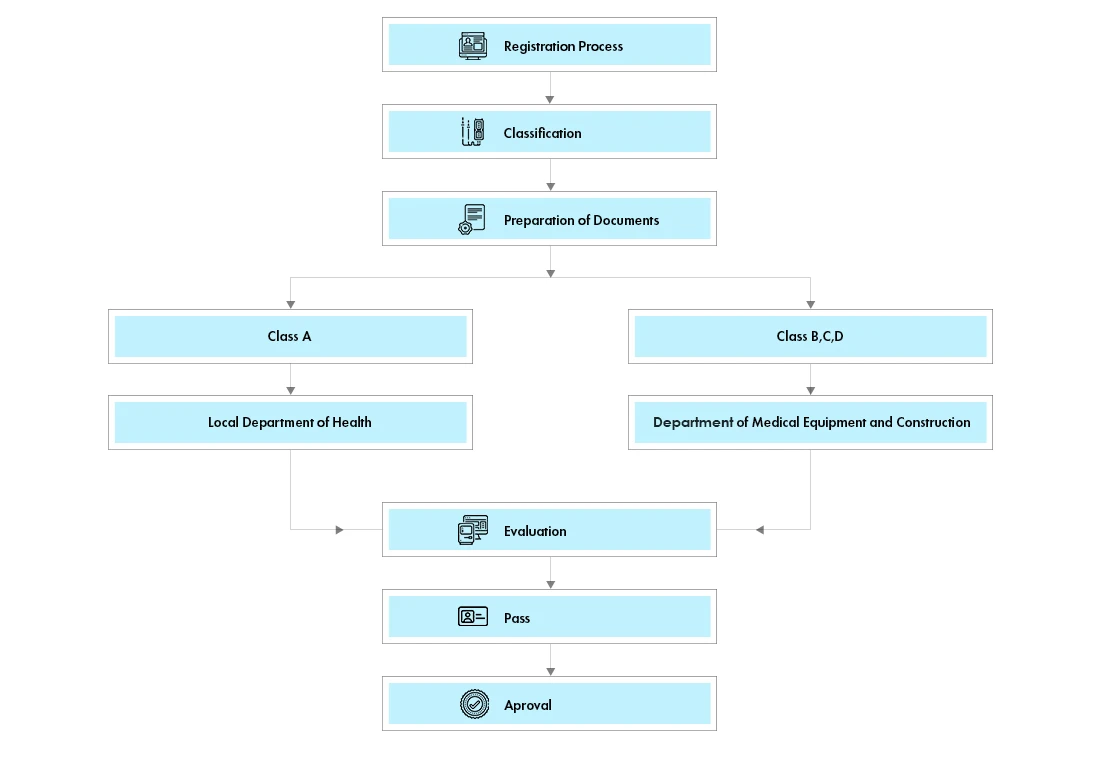
Évaluation des données techniques : Département de l'équipement médical et de la construction (DMEC) du ministère de la santé
Labelling : Décret n°. 111/2021
Format de soumission : En ligne- Délais : 15 - 60 jours
Langue : Anglais et vietnamien
Classification des dispositifs médicaux au Vietnam
Les dispositifs sont classés en 4 classes (A, B, C et D) qui sont également classées en deux groupes, le groupe 1 (classe A) et le groupe 2 (classes B, C et D). La classification officielle est disponible auprès du Département vietnamien des équipements médicaux et des travaux de santé (DMEHW).
| Groupe | Classe | Risque |
|---|---|---|
Groupe 1 | Classe A | Faible niveau |
Groupe 2 | Classe B | Niveau de risque moyen plus faible |
Classe C | Niveau moyen supérieur des risques | |
Classe D | Niveau de risque élevé |
Représentant local autorisé du Vietnam
La désignation d'un agent vietnamien fiable et compétent pour les fabricants étrangers est cruciale, car il doit prendre en charge les services de garantie offerts par le fabricant dans le cadre de la vente de l'appareil. La traduction en vietnamien est indispensable pour pénétrer dans la région, ce qui peut s'avérer difficile dans la pratique.
Freyr offre un soutien réglementaire couvrant l'ensemble des activités telles que l'obtention d'un numéro de reconnaissance de vente libre impliqué dans l'approbation des dispositifs médicaux par les autorités. Nous fournissons également le soutien d'experts linguistiques pour maintenir intacte la perspective réglementaire de la traduction. Nous répondons aux besoins post-approbation des clients afin de maintenir la conformité tout au long du cycle de vie du produit au Vietnam.
Enregistrement des dispositifs médicaux au Vietnam
Tous les produits de classe A et B nécessitent une licence d'autorisation de mise sur le marché (AMM). Les dispositifs de classe A et B feront l'objet d'un examen administratif rapide par le ministère de la santé de la province où se trouve le titulaire de l'enregistrement.
Les appareils de classe C et D devront désormais demander une licence d'autorisation de mise sur le marché (AMM). Les licences MA resteront valables indéfiniment.
Déroulement du processus
Gestion du cycle de vie des appareils après leur approbation
Freyr aide les fabricants étrangers dans la gestion end-to-end du cycle de vie des dispositifs end-to-end , y compris les activités post-autorisation, telles que :
- Gestion des modifications après approbation - modifications des approbations de dispositifs médicaux existantes telles que l'ajout de nouvelles variantes, d'accessoires, l'ajout de nouvelles indications d'utilisation, etc.
- Maintien des agréments et de l'enregistrement par le paiement en temps voulu des frais administratifs et d'enregistrement
- Renouvellement des licences
- Liaison entre le DMEHW et le fabricant
- Gestion des importations
Résumé
Groupe | Classe | Risque | Voie réglementaire | Calendrier | Validité |
|---|---|---|---|---|---|
Groupe 1 | Classe A | Faible niveau | Déclaration de la norme applicable | 15 - 60 jours | Illimité |
Groupe 2 | Classe B | Niveau de risque moyen plus faible | Certificat d'enregistrement de vente libre | 15 - 60 jours | 5 ans |
Classe C | Niveau moyen supérieur des risques | Certificat d'enregistrement de vente libre | 15 - 60 jours | 5 ans | |
Classe D | Niveau de risque élevé | Certificat d'enregistrement de vente libre | 15 - 60 jours | 5 ans |
Expertise Freyr
- Due-Diligence réglementaire
- Classification officielle
- Enregistrement de l'appareil
- Licence d'importation
- Aide à l'étiquetage
- Aide à la traduction
- Identification et qualification des distributeurs
- Surveillance post-marketing
- Gestion des changements après approbation
- Renouvellement et transfert de licence
- Soumission et liaison
- Dédouanement

