SmPC résumé des caractéristiques du produit, est un document juridique qui fait partie de l'autorisation de mise sur le marché de chaque médicament. Ce document sert de base d'information sur l'utilisation des médicaments pour les professionnels de santé. Les informations contenues dans le SmPC régulièrement mises à jour en fonction des dernières informations disponibles. SmPC plus d'informations que la notice d'emballage. Les SmPC sont disponibles via les sources suivantes :
- Sites web des autorités sanitaires, telles que l'Agence européenne des médicaments (EMA)
- Dictionnaires de médecine
En quoi consiste un SmPC?
- Informations relatives à l'utilisation du médicament
- Informations qualitatives et quantitatives sur les avantages et les risques des médicaments
- Informations sur la posologie
- Méthode de gestion
- Informations pharmacologiques
- Informations sur les soins individuels
Structure d'un SmPC
La structure du SmPC définie par la législation pharmaceutique européenne. Les informations contenues dans le SmPC être spécifiques au produit et peuvent faire l'objet de renvois afin d'éviter toute redondance. Elles doivent être rédigées dans un langage clair et ne doivent pas prêter à ambiguïté. Le SmPC divisé en six sections principales :
- Nom du produit
- Composition
- Forme pharmaceutique
- Données cliniques - Comprend les indications thérapeutiques, les recommandations de dosage et les informations relatives à la sécurité.
- Propriétés pharmacologiques - Tient compte des indications thérapeutiques des éléments cliniques et de leurs effets indésirables potentiels.
- Particularités pharmaceutiques - Comprend les informations réglementaires relatives au médicament.
Conformément à EMA d'un SmPC être représentée comme suit :
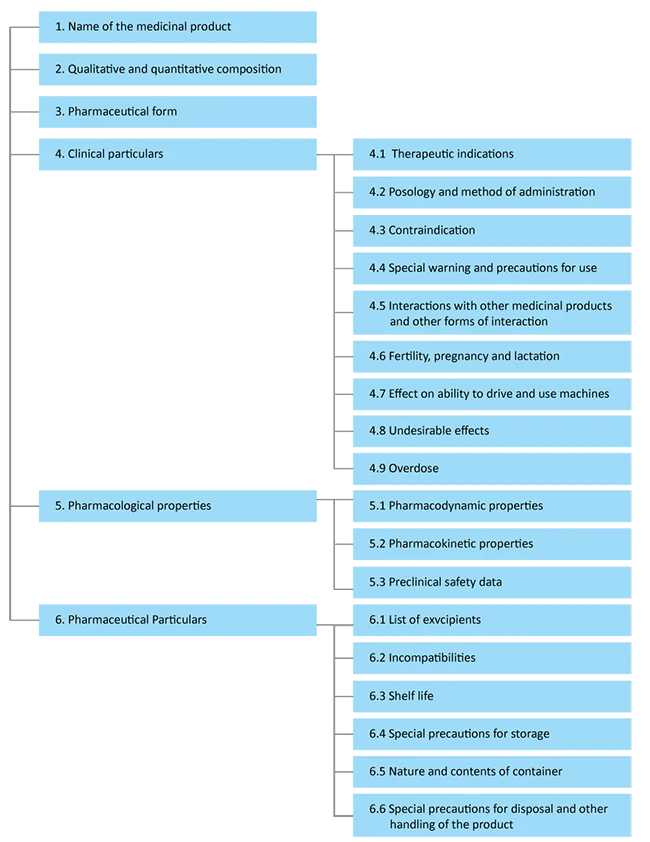
Référence : EMA
Quelles informations ne figurent pas dans le SmPC?
- Informations disponibles dans les rapports d'évaluation publics (détails du développement scientifique)
- Informations sur les indications non approuvées
- Questions pour lesquelles les données sont insuffisantes
- Conseils généraux sur les conditions pharmacologiques
SmPC important SmPC maintenir à jour le SmPC tout au long du cycle de vie d'un médicament, car il fait partie intégrante de son autorisation de mise sur le marché. SmPC donc fortement recommandé de rédiger un SmPC conforme. Vous recherchez l'aide d'un expert en réglementation pour élaborer un SmPC? Reach Freyr sales@freyrsolutions.com.