BIMO signifie « Bioresearch Monitoring » (surveillance de la recherche biologique), un programme d'inspection sur site et d'audit des données visant à contrôler tous les aspects de la conduite et de la communication des résultats des recherches réglementées par US and Drug Administration (FDA) US . Ce programme a été créé en 1977 après que la nécessité d'auditer les sites de recherche clinique a été identifiée. L'objectif principal de ce programme est de garantir la qualité et l'intégrité des données soumises pour l'autorisation de nouveaux produits et les demandes de commercialisation. En outre, ce programme protège également les droits et le bien-être des sujets humains et animaux participant aux recherches FDA.
Les principaux objectifs du programme BIMO
Chaque année, plus de 1000 inspections sont effectuées. Les principaux objectifs couverts par le programme BIMO sont les suivants :
- Audit des données cliniques
- Inspection de la recherche clinique en cours
- Inspection des laboratoires non cliniques
- Inspection des commissions d'examen institutionnelles (IRB)
Quels sont les produits concernés par l'audit BIMO ?
Le BIMO s'applique aux médicaments, aux produits biologiques, aux dispositifs médicaux, aux produits alimentaires, aux produits du tabac et aux produits vétérinaires. Le programme de conformité est supervisé par les six (06) centres de produits de la FDA- Center for Biologics Evaluation and Research (CBER), Center for Devices and Radiological Health (CDRH), Center for Drug Evaluation and Research (CDER), Center for Food Safety and Applied Nutrition (CFSAN), Center for Tobacco Products (CTP) et Center for Veterinary Medicine (CVM).
Quelles sont les entreprises soumises à l'audit BIMO ?
Les entreprises nationales et internationales qui exercent l'une ou l'autre des activités ci-dessous sont soumises aux exigences du contrôle de la biorecherche.
- Laboratoires d'essais non cliniques pour le respect des bonnes pratiques de laboratoireGLP
- Enquêteurs cliniques pour le respect des bonnes pratiques cliniques (BPC)
- Parrains
- Organisations de recherche sous contrat (CRO)
- Moniteurs d'essais cliniques
- Installations de bioéquivalence in vivo
- Commissions d'examen institutionnelles (CEI)
Quels sont les programmes de conformité qui relèvent du programme BIMO ?
FDA US FDA effectuer un audit BIMO à tout moment dans le cadre des sept (07) programmes de conformité multicentriques. Ces sept programmes de conformité multicentriques sont mis en œuvre par le biais de :
- Inspection du chercheur clinique (CI) et du chercheur commanditaire (SI)
- Inspection de la Commission d'examen institutionnelle (CEI)
- Inspection des organismes de recherche sous contrat/parrains/moniteursCRO)
- Inspection des bonnes pratiques de laboratoireGLP
- Inspection de la bioéquivalence et de la biodisponibilité (BEQ)
- Inspection de la notification des effets indésirables des médicaments après leur mise sur le marché (PADE)
- Évaluation des risques, atténuation et stratégie (REMS) Inspection des rapports
Chacun de ces programmes décrit en détail l'étendue de l'examen ou de l'inspection à effectuer pour garantir la conformité avec la FDA.
Quels sont les règlements applicables à l'audit BIMO ?
Les règlements - 21 CFR 50 - Protection des sujets humains, 21 CFR 54 - Divulgation financière, 21 CFR 56 - OIR, 21 CFR 58 - Bonnes pratiques de laboratoire pour les laboratoires non cliniques, 21 CFR 809 - Produits de diagnostic in vitro, et 21 CFR 812 - Exemption pour les dispositifs d'investigation - sont applicables à l'audit BIMO.
Combien d'audits sont réalisés chaque année dans le cadre du programme BIMO ?
Le nombre d'audits BIMO menés par laFDA US FDA chaque année. Ces dernières années, le nombre d'inspections sur site a diminué en raison de la pandémie de COVID-19, et la FDA dû suspendre toute surveillance sur site des études cliniques. Seules les études cliniques critiques et cruciales ont fait l'objet d'un suivi.
Les "évaluations réglementaires à distance" (ERD) ont été introduites lors de la pandémie de COVID-19 afin de contrôler à distance la recherche réglementée. Ces évaluations sont réalisées par vidéoconférence et constituent une initiative volontaire visant à évaluer à distance les données et les processus. Il convient toutefois de noter que les évaluations à distance ne sont pas l'équivalent ou une alternative à l'inspection sur place, mais qu'il s'agit simplement d'une procédure qui a évolué en raison de la pandémie de COVID-19.
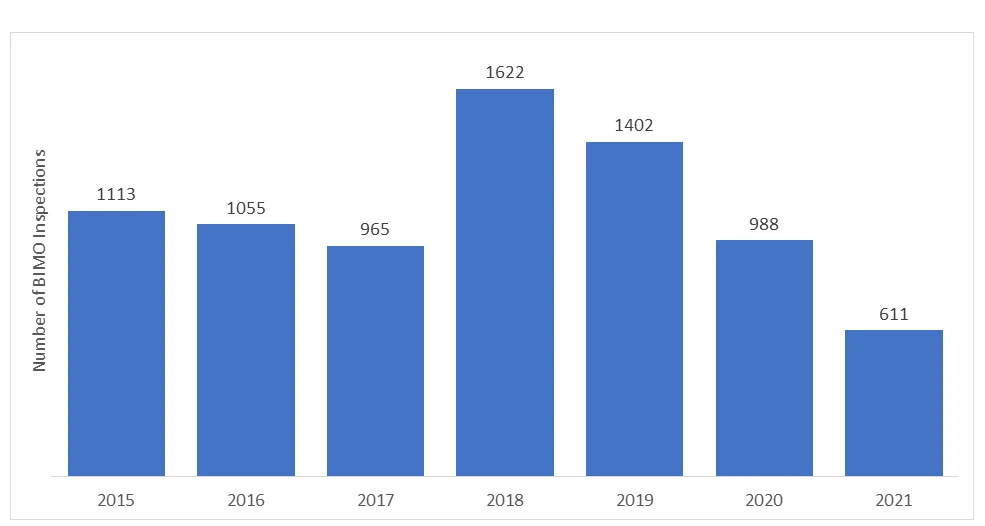
*Les données représentées pour les années 2020 et 2021 n'incluent pas les inspections de l'ORR.
Combien d'évaluations réglementaires à distance (ERD) ont été réalisées au cours de la pandémie de COVID-19 dans le cadre du programme BIMO ?
En 2021, l'adoption de l'inspection RRA a considérablement augmenté dans tous les programmes. En avril 2021, la FDA a publié un document d'orientation intitulé "Remote Interactive Evaluations of Drug Manufacturing and Bioresearch Monitoring Facilities During the COVID-19 Public Health Emergency Guidance for Industry" (Évaluations interactives à distance des installations de fabrication de médicaments et de surveillance de la recherche biologique pendant l'urgence de santé publique COVID-19), qui fournit des informations exhaustives sur la procédure suivie par la FDApour effectuer les évaluations des risques réglementaires.
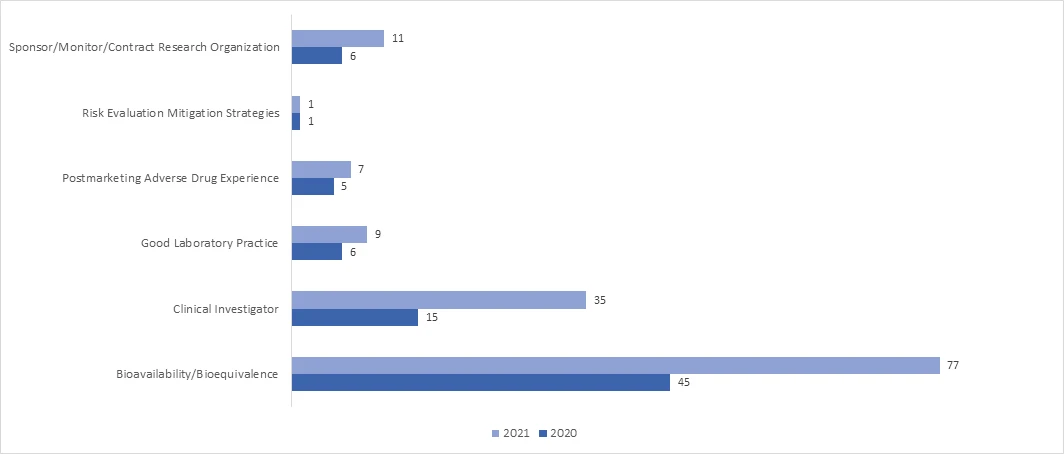
Quels sont les résultats possibles d'un audit BIMO ?
Au cours de l'audit BIMO, laFDA US FDA décider de prendre l'une des mesures énumérées ci-dessous en fonction de la conformité :
1. Aucune action indiquée (NAI)
Le NAI est applicable lorsque l'inspecteur de terrain de FDA n'a pas identifié de pratiques répréhensibles ou seulement des problèmes mineurs pour lesquels une action supplémentaire n'est pas justifiée.
2. Action volontaire indiquée (VAI)
Le VAI est applicable lorsque des pratiques répréhensibles ont été identifiées mais ne sont pas significatives.
3. Action officielle indiquée (OAI)
L'OAI est applicable lorsque des pratiques répréhensibles compromettant l'intégrité des données et/ou les droits des sujets humains ont été identifiées.
Quelles sont les non-conformités les plus courantes émises dans le cadre de l'audit BIMO ?
Parmi les non-conformités les plus courantes observées lors de l'audit BIMO, citons -
- Ne pas conserver un suivi adéquat des dossiers
- Échec par rapport au plan d'investigation
- Non-respect de la réglementation
- Défaut de suivi des protocoles
- Protection inadéquate des sujets
- L'obligation de rendre compte du produit qui fait l'objet de l'enquête n'est pas satisfaisante.
L'audit BIMO est crucial pour tout développeur ou fabricant de dispositifs médicaux et de technologies innovants qui envisage de commercialiser son produit sur le US . Il est très important de se conformer aux réglementations et aux directives afin d'éviter les écueils décrits ci-dessus.
Vous avez besoin d'aide en ce qui concerne les inspections d'audit BIMO ? Reach Freyr. Restez informé. Restez conforme.