Les rapports sur les dispositifs médicaux (MDR) sont des outils de surveillance post-commercialisation que la Food and Drug AdministrationFDA utilise pour contrôler les performances des dispositifs, détecter les problèmes de sécurité potentiels liés aux dispositifs et contribuer à l'évaluation des avantages et des risques des dispositifs. L'objectif de la surveillance post-commercialisation est de détecter et de traiter en temps utile les événements indésirables liés aux dispositifs. Il permet aux médecins, aux établissements de soins de santé, aux fabricants et aux consommateurs de comprendre la sécurité et l'efficacité des dispositifs après leur mise sur le marché.
Le MDR s'applique à toutes les classes de dispositifs médicaux fabriqués ou importés aux États-Unis d'Amérique. Les fabricants de dispositifs médicaux qui souhaitent commercialiser leurs dispositifs aux États-Unis doivent se conformer au MDR, faute de quoi ils s'exposent à des sanctions financières. Le MDR est applicable aux États-Unis, y compris à l'étranger, c'est-à-dire qu'il s'applique aux dispositifs médicaux légalement commercialisés aux États-Unis, qu'ils soient fabriqués aux États-Unis ou à l'étranger. En outre, il existe différents cas d'application d'une MDR, tels que :
- si un dispositif est fabriqué aux États-Unis, distribué localement et sur d'autres marchés
- lorsqu'un dispositif est fabriqué aux États-Unis mais distribué sur d'autres marchés
- lorsqu'un dispositif est fabriqué dans le pays étranger, fourni aux États-Unis et sur d'autres marchés
- lorsqu'un dispositif est fabriqué dans le pays étranger et distribué localement et
- lorsqu'un dispositif fait l'objet d'une enquête aux États-Unis
Le RIM et le déroulement du processus de déclaration
Le règlement MDR contient de nombreuses exigences obligatoires pour les fabricants, les importateurs et les installations d'utilisation de dispositifs, qui doivent signaler à la FDA certains événements indésirables liés aux dispositifs et certains problèmes liés aux produits. L'organigramme ci-dessous détaille la procédure de déclaration étape par étape.
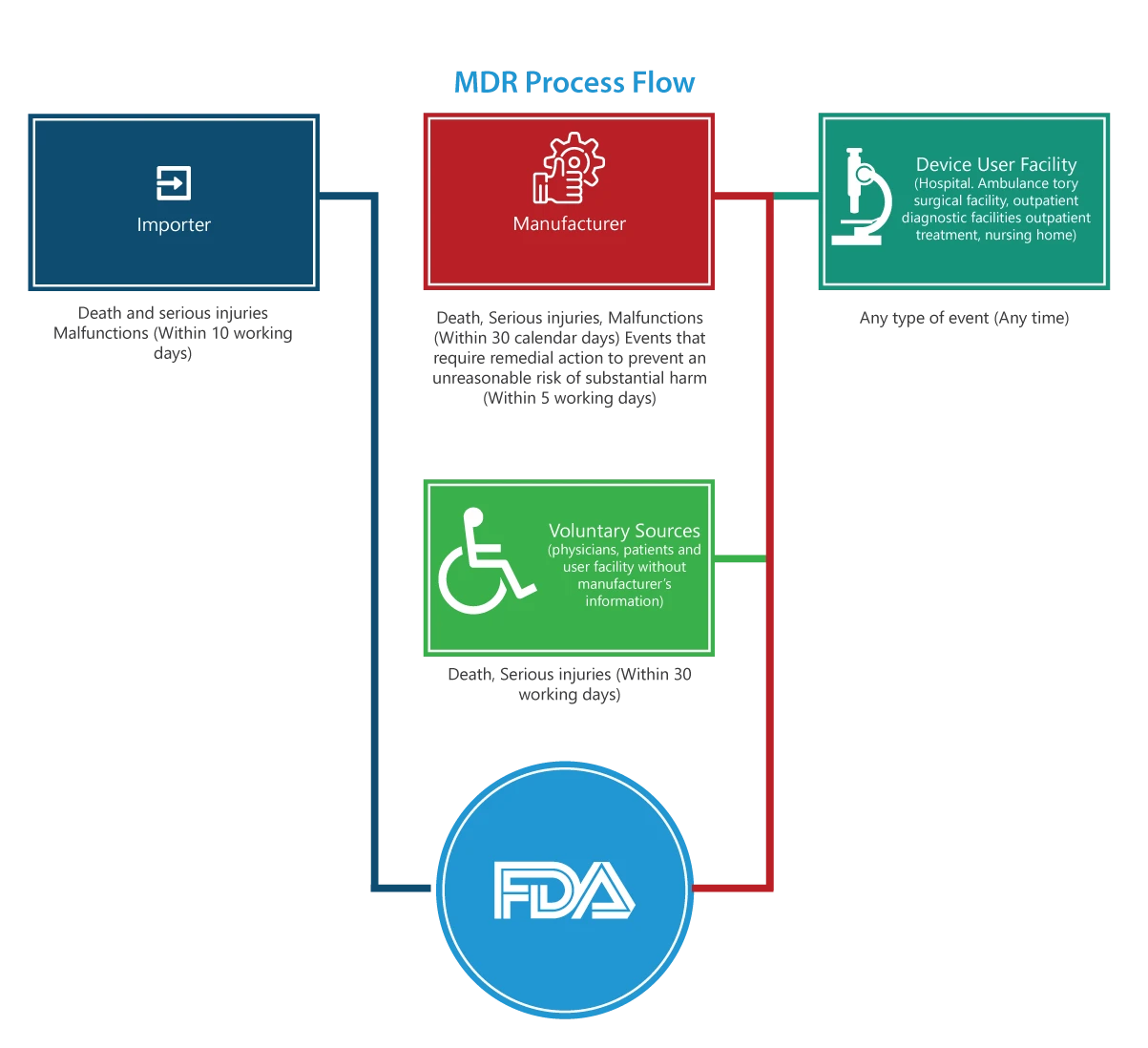
À qui s'applique-t-elle ?
Importateurs
Les rapports sur les décès, les blessures graves et les dysfonctionnements doivent être soumis à la FDA et au fabricant dans un délai de 30 jours ouvrables. Si le dysfonctionnement peut entraîner des blessures ou des décès ailleurs, les importateurs doivent le signaler au fabricant.
Fabricants
Les rapports relatifs à un événement (décès, blessures graves et dysfonctionnements) désigné par la FDA ou à un événement nécessitant une action corrective pour prévenir un risque déraisonnable de préjudice substantiel pour la santé publique doivent être soumis à la FDA dans les 5 jours ouvrables en remplissant le formulaire 3500A.
Établissement utilisateur du dispositif (hôpital, centre de chirurgie ambulatoire, maison de retraite, centre de diagnostic ambulatoire ou centre de traitement ambulatoire)
Les rapports doivent être soumis au fabricant du dispositif au plus tard 10 jours ouvrables après le jour où l'établissement a connaissance d'informations selon lesquelles un dispositif a ou pourrait avoir causé ou contribué à causer une blessure grave à un patient de l'établissement. Si le fabricant est inconnu, l'établissement doit soumettre le rapport à la FDA.
Groupes bénévoles
Les patients, les professionnels de la santé et les consommateurs qui constatent un problème lié à un dispositif médical peuvent le signaler à la FDA par l'intermédiaire de MedWatch.
eMDR
La FDA a rendu obligatoire le MDR électronique (eMDR) en 2015 afin d'identifier les problèmes critiques de qualité et d'intégrité des données associés à la déclaration des blessures graves liées à toutes les catégories de dispositifs médicaux.
Les fabricants peuvent soumettre leur eMDR par l'intermédiaire d'une passerelle de soumission électroniqueESG. La passerelle électronique prend jusqu'à 48 heures pour envoyer un accusé de réception à partir du moment où le rapport est soumis. En cas d'erreur lors de la soumission du rapport, un message s'affiche pour permettre d'effectuer la ou les corrections.
eMDR - Quels sont les avantages ?
L'eMDR offre de nombreux avantages par rapport au mécanisme de déclaration manuelle (c'est-à-dire le MDR). Voici quelques avantages notables sur lesquels les fabricants, les agences et les patients peuvent compter :
- L'outil de soumission eMDR améliore la collaboration entre une organisation, l'agence de santéFDA et les patients.
- L'eMDR permet de réaliser des économies. L'automatisation réduit les frais administratifs et la communication traditionnelle ; elle contribue à accélérer le processus et favorise la notification efficace des événements, ce qui se traduit par une interaction immédiate avec la FDA.
- Les processus manuels impliquent une paperasserie importante, peuvent être longs et difficiles à suivre et à traiter. La soumission eMDR est automatisée et centralisée. Les dossiers peuvent être récupérés facilement, ce qui permet de gagner beaucoup de temps lors de l'examen.
- L'eMDR permet aux parties de signaler rapidement les erreurs de soumission, contrairement aux correspondances manuelles et fastidieuses avec la FDA.
- L'eMDR sert de point d'entrée unique pour traiter toutes les soumissions électroniques dans un environnement hautement sécurisé et il est avantageux parce que les plaintes de l'organisation peuvent être liées directement au formulaire MedWatch et intégrées dans la passerelle de la FDA.
L'eMDR et le processus de déclaration
Le règlement eMDR impose aux fabricants, aux importateurs et aux utilisateurs de dispositifs de signaler à la FDA certains événements indésirables et problèmes liés aux dispositifs. L'organigramme ci-dessous détaille la procédure de notification étape par étape.
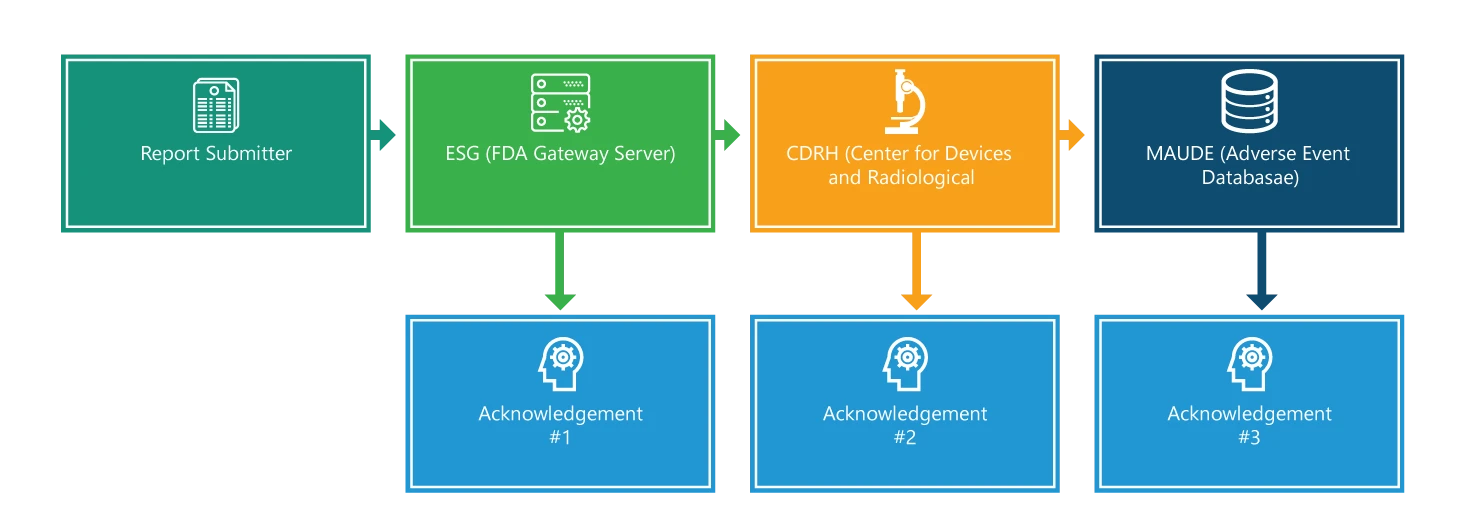
Le processus de notification comprend quatre étapes. À l'exception de la première, chaque étape fait l'objet d'un accusé de réception. En outre, chaque étape est assortie d'informations supplémentaires qui faciliteront le processus.
Étape 1 : Soumission du rapport
Soumission d'un eMDR. Pour déposer une demande, il faut d'abord disposer d'une signature électronique et s'assurer que les noms de fichiers de la demande ne comportent qu'un seul point, qui est utilisé pour indiquer l'extension du type de fichier (par exemple 555xml ou 555.pdf). Toutefois, les délais de livraison et de traitement de la demande dépendent de la taille globale de votre soumission ; les soumissions plus importantes prennent plus de temps à être livrées et traitées.
Étape 2 : Passerelle de soumission électroniqueESG
Lorsque votre demande parvient à l'ESG, vous devriez rapidement recevoir un accusé de réception n° 1, à moins que l'ESG ne soit en panne pour cause de maintenance. Vous êtes tenu de vérifier l'état de votre dossier de demande de remboursement sur le site web de ESG .
Étape 3 : CRDH
L'eMDR est automatiquement acheminé de l'ESG vers le Center for Devices and Radiological Health (CDRH). Une fois qu'il est acheminé, comme à l'étape 2, vous devriez recevoir un accusé de réception, c'est-à-dire le numéro 2.
Étape 4 : Expérience des dispositifs du fabricant et de l'utilisateur (MAUDE)
Lorsque le CDRH valide et met à jour la demande dans la base de données des événements indésirables (MAUDE), l'auteur de la demande devrait recevoir un accusé de réception n° 3. Il convient de noter que toute erreur survenant au cours de la validation et du chargement est enregistrée.
Le rapport sur les dispositifs médicaux (MDR) est un processus essentiel qui permet de sauver des vies et de protéger les patients contre des risques inutiles. Il garantit que toutes les parties impliquées dans les soins aux patients sont responsables et vigilantes dans l'utilisation des dispositifs.
L'eMDR facilite la rédaction des rapports, mais la documentation et le suivi peuvent nécessiter beaucoup de ressources. Faites-le bien du premier coup ; us à l'adresse sales@freyrsolutions.com.