Le Ninsho (certification des dispositifs médicaux) est un système de certification tiers au Japon dans lequel un organisme de certification agréé (RCB), accrédité par le ministre de la Santé, du Travail et des Affaires sociales (MHLW), certifie les dispositifs médicaux hautement contrôlés désignés. Il s'applique aux dispositifs de classe II et à un nombre limité de dispositifs de classe III associés à une norme industrielle japonaise (JIS). Quelques dispositifs médicaux de classe II pour lesquels aucun critère de certification n'a été établi doivent être approuvés dans le cadre du programme Shonin.
Quelles sont les autres voies d'enregistrement des dispositifs au Japon ?
Au Japon, les voies Todokede et Shonin sont également utilisées pour l'approbation des dispositifs médicaux, en plus de la voie Ninsho. En fonction de la catégorie de risque du dispositif et de la disponibilité des prédicats au Japon, le fabricant doit planifier soigneusement sa demande d'homologation.
Quels sont les prérequis pour la certification Ninsho ?
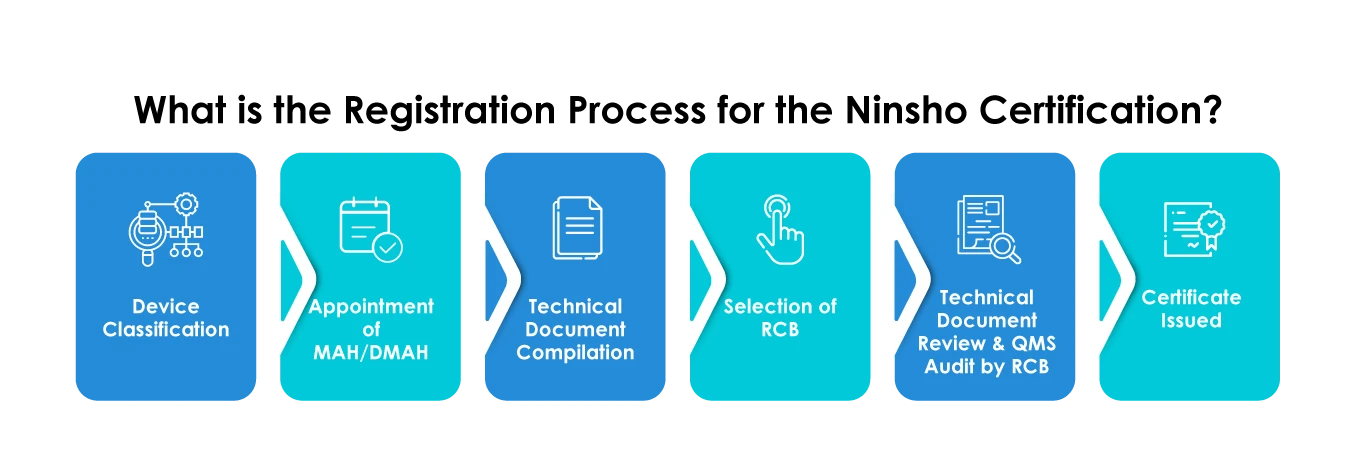
Les fabricants qui enregistrent leurs dispositifs par le biais de la filière Ninsho doivent planifier méticuleusement les soumissions en fonction des éléments suivants :
- Sélection d'une BCR
- Soumission de données générales sur les dispositifs, telles que la catégorie de dispositifs médicaux, l'utilisation prévue, les données d'analyse des risques d'efficacité, les données cliniques, etc.
- Fournir un résumé de la documentation technique (STED)
- Les documents fournis doivent être rédigés en japonais uniquement.
- Les fabricants étrangers doivent obligatoirement nommer un titulaire d'autorisation de mise sur le marché (MAH) ou un titulaire désigné d'autorisation de mise sur le marché (DMAH).
- Les fabricants étrangers doivent s'enregistrer auprès MHLW obtenir un certificat d'enregistrement de fabricant étranger (FMR) pour leurs établissements de fabrication.
Qu'est-ce qu'une BCR ?
Les organismes de certification enregistrés (RCB) sont des organismes de certification tiers accrédités par le MHLW. Les RCB sont chargés d'examiner et de certifier les dispositifs médicaux éligibles et soumis à la procédure Ninsho. Les RCB sont également chargés de réaliser l'audit du système de gestion de la qualité (QMS) des installations du fabricant.
Quelles sont les exigences en matière de SMQ pour l'enregistrement d'un dispositif dans le cadre de la filière Ninsho ?
Les fabricants doivent se conformer à toutes les exigences du système de gestion de la qualité définies dans l'ordonnance 169. Le MAH ou le DMAH doit soumettre la demande aux RCB. Les OCR procèdent à une inspection détaillée du système de gestion de la qualité dans les installations du fabricant et, si la mise en œuvre du système de gestion de la qualité est satisfaisante, ils délivrent le certificat.
Quel est le délai moyen nécessaire pour obtenir la certification Ninsho ?
L'OCR a généralement besoin de trois (03) à cinq (05) mois pour achever l'évaluation technique, effectuer l'audit du système de gestion de la qualité et délivrer le certificat Ninsho.
Y a-t-il une date d'expiration pour la certification Ninsho ?
L'enregistrement des dispositifs médicaux n'expire pas, mais le promoteur doit renouveler les certificats du système de gestion de la qualité tous les cinq (05) ans.
Le Japon, troisième marché mondial pour les dispositifs médicaux après les États-Unis et la Chine, offre de formidables opportunités aux fabricants de dispositifs médicaux du monde entier. Les fabricants souhaitant commercialiser leurs dispositifs au Japon doivent planifier soigneusement la certification et l'homologation de leurs dispositifs médicaux, car PMDA des exigences réglementaires spécifiques. Les fabricants peuvent choisir un partenaire réglementaire fiable pour accéder sans difficulté au marché japonais.
Pour en savoir plus sur la certification des dispositifs médicaux au Japon ou sur toute autre réglementation PMDA , contactez Freyr dès aujourd'hui !