Les dispositifs médicaux innovants sont essentiels pour améliorer les résultats des soins de santé, répondre à l'évolution des besoins médicaux et fournir des solutions rentables aux patients et aux prestataires de soins de santé. La stratégie SAKIGAKE est une procédure accélérée d'examen et d'approbation des dispositifs médicaux innovants au Japon. Cette stratégie a été lancée par le ministère japonais de la santé, du travail et des affaires socialesMHLW en 2015, dans le but d'accélérer le développement et la commercialisation de dispositifs médicaux innovants au Japon.
Dans le cadre de la stratégie SAKIGAKE, les dispositifs médicaux qui répondent à certains critères d'innovation peuvent être examinés et approuvés en priorité par l'Agence des produits pharmaceutiques et des dispositifs médicauxPMDA, l'agence réglementaire responsable de l'approbation des dispositifs médicaux au Japon. Les critères de désignation de l'innovation sont les suivants
- Dispositifs d'une efficacité remarquable ; le dispositif devrait apporter un avantage clinique significatif grâce à un nouveau mécanisme d'action et une amélioration radicale pour les patients par rapport aux dispositifs médicaux existants.
- Premièrement, l'appareil peut être homologué au Japon ou simultanément au Japon et dans d'autres pays.
- Le dispositif a le potentiel de répondre à des besoins médicaux non satisfaits au Japon. L'état pathologique visé doit être grave, menacer le pronostic vital ou présenter des symptômes persistants.
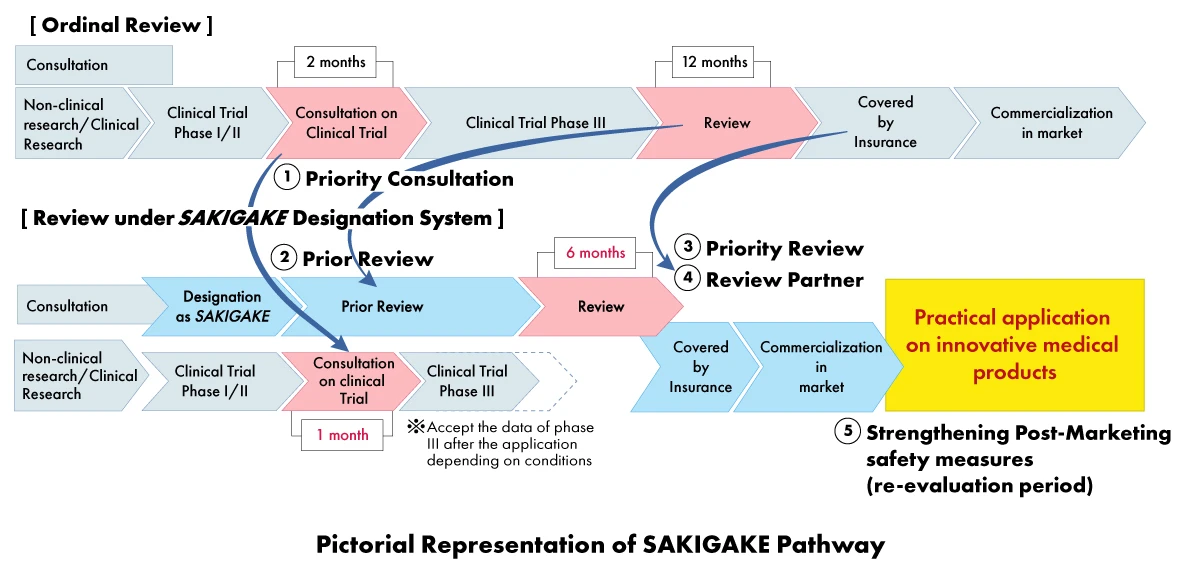
Dans le cadre de la stratégie SAKIGAKE, les fabricants de dispositifs médicaux peuvent bénéficier d'une série d'avantages, notamment
- Consultation prioritaire: Réduction du délai d'attente pour la consultation sur les essais cliniques à un (01) mois.
- Examen prioritaire: Les produits désignés par SAKIGAKE font l'objet d'un examen prioritaire, l'objectif étant d'achever le processus d'examen dans un délai de six (06) mois au lieu de douze (12) mois.
- Examen efficace avant la demande: Encourager la consultation et accepter les documents en anglais.
- Partenaire d'examen dédié: Chaque produit désigné par SAKIGAKE se voit attribuer un responsable d'examen dédié pour l'ensemble du processus d'approbation.
- Renforcement des mesures de sécurité post-commercialisation: Extension de la période de réexamen et facilitation des liens avec les sociétés scientifiques.
Comment postuler ?
- Par le demandeur : Le demandeur soumet la demande à la Division de l'évaluation et de l'octroi des licences (ELD) de PMDA .
- Par PMDA: L'ELD se rapproche d'un candidat potentiel.
P.C- PMDA, Japon.
Globalement, le système SAKIGAKE offre une voie accélérée pour le développement et l'approbation de dispositifs médicaux innovants au Japon. Il vise à améliorer les résultats pour les patients et à promouvoir l'innovation dans l'industrie des dispositifs médicaux. Le fabricant doit consulter la PMDA dès le début du processus de développement pour discuter des exigences réglementaires et recevoir un retour d'information sur ses plans de développement de produits.
Pour en savoir plus sur les procédures d'enregistrement des dispositifs médicaux au Japon, reach un expert en réglementation dès maintenant ! Restez informé. Restez en conformité.