Shonin (Pre-Market Approval) est la voie réglementaire pour l'enregistrement des dispositifs médicaux au Japon. La voie Shonin est principalement destinée à l'enregistrement des dispositifs médicaux de classe II et III pour lesquels les normes de classification de la PMDAne sont pas disponibles. Pour les dispositifs de classe IV à haut risque, les fabricants doivent également soumettre la demande Shonin. La PMDA est responsable de l'examen et de l'approbation de la demande Shonin.
Quelles sont les autres voies d'enregistrement des dispositifs au Japon ?
Outre le Shonin, les filières Todokede et Ninsho sont également utilisées pour l'homologation des dispositifs médicaux au Japon. Les fabricants de dispositifs médicaux peuvent choisir l'une d'entre elles en fonction de la classe de risque du dispositif et de la disponibilité des prédicats au Japon. Le fabricant doit identifier la classification du dispositif et rechercher la disponibilité de la norme industrielle japonaise (JIS) avant de déterminer la voie d'enregistrement applicable.
- Todokede (Pre-Market Submission) - Elle s'applique aux dispositifs de classe I et exige des fabricants qu'ils soumettent une notification préalable à la mise sur le marché à la PMDA pour approbation.
- Ninsho (Certification préalable à la mise sur le marché) - Elle s'applique aux dispositifs génériques de classe II et III soumis à des normes de certification (normes JIS). L'organisme de certification agréé (OCA) est responsable de l'examen et de l'approbation de la demande.
Quelles sont les conditions préalables à l'inscription au programme Shonin ?
Les fabricants qui enregistrent leurs dispositifs par la voie Shonin doivent planifier méticuleusement les demandes. Ils doivent s'assurer des points suivants
- Soumission de données générales sur les dispositifs, telles que la catégorie de dispositifs médicaux, l'utilisation prévue, les données d'analyse des risques d'efficacité, les données cliniques, etc.
- Fournir un résumé de la documentation technique (STED)
- Fourniture de documents en langue japonaise uniquement
- Les fabricants étrangers doivent obligatoirement nommer un titulaire d'autorisation de mise sur le marché (MAH )ou un titulaire désigné d'autorisation de mise sur le marché (DMAH).
- Les fabricants étrangers doivent obtenir un certificat d'enregistrement de fabricant étranger (FMR) pour leurs établissements de fabrication.
Quelles sont les exigences en matière de système de gestion de la qualité pour l'enregistrement d'un dispositif dans le cadre de la filière Shonin ?
Les fabricants doivent se conformer à toutes les exigences du système de gestion de la qualité définies dans l'ordonnance 169. Le promoteur, le DMAH ou le MAH doit déposer une demande auprès du PMDA. Le PMDA effectue une inspection détaillée du système de gestion de la qualité dans les installations du fabricant et délivre le certificat lorsque la mise en œuvre du système de gestion de la qualité est satisfaisante.
Quelle est la procédure d'enregistrement pour l'approbation d'un dispositif dans le cadre de la filière Shonin ?
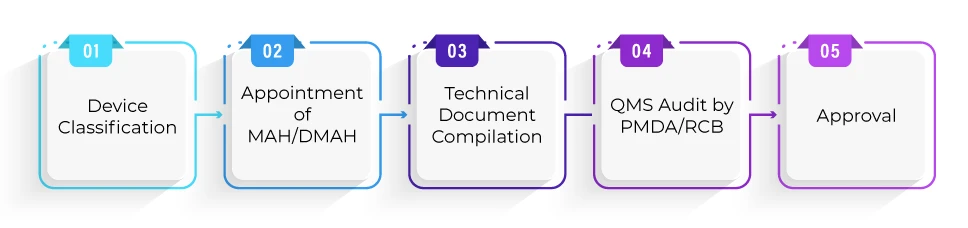
Quel est le délai moyen requis pour l'approbation d'un dispositif dans le cadre de la procédure Shonin ?
La PMDA a généralement besoin de 12 mois pour l'évaluation technique à partir de la date de réception de la demande de Shonin. Le fabricant doit tenir compte du temps nécessaire à la préparation des documents de soumission ou à la réalisation des études cliniques dans le calendrier de son projet.
Existe-t-il un délai d'expiration pour l'enregistrement d'un dispositif dans le cadre de la voie Shonin ?
L'enregistrement des dispositifs médicaux n'expire pas, mais le promoteur doit renouveler les certificats du système de gestion de la qualité tous les cinq (05) ans.
Le Japon est un marché lucratif, mais il s'accompagne intrinsèquement de complexités réglementaires et de barrières linguistiques. Les fabricants doivent tenir compte de ces facteurs et planifier de manière proactive leur stratégie de mise sur le marché (GTM) pour le Japon. Les fabricants de dispositifs médicaux et de DIV peuvent choisir d'externaliser toutes les nuances réglementaires auprès d'un partenaire réglementaire fiable et d'utiliser les ressources pour se concentrer sur d'autres éléments essentiels.
Pour en savoir plus sur l'homologation des dispositifs médicaux Shonin au Japon ou sur toute autre réglementation de PMDA au Japon, contactez dès aujourd'hui les experts en réglementation de Freyr.