FDAUS a pour objectif principal d'examiner en permanence et de combler le fossé entre les processus réglementaires afin de garantir l'importation et la vente ininterrompues de dispositifs médicaux nouveaux et de haute qualité sur le US .FDA 1998, laFDA US a publié un programme intitulé « The New 510(k) Paradigm: Alternate Approaches to Demonstrating Substantial Equivalence in Premarket Notifications » (Le nouveau paradigme 510(k) : autres approches pour démontrer l'équivalence substantielle dans les notifications préalables à la mise sur le marché). Il vise à établir une procédure efficace de soumission FDA (k) FDA qui comprend certaines modifications par rapport à la demande 510(k) déjà approuvée. Cette nouvelle notification 510(k) propose trois types de soumissions, à savoir la 510(k) spéciale, la 510(k) abrégée et la 510(k) traditionnelle. En 2019, laFDA US a publié un document d'orientation spécial 510(k) décrivant une voie facultative pour les fabricants qui apportent certaines modifications bien définies à leur dispositif commercialisé légalement.
Pourquoi un 510(k) spécial ?
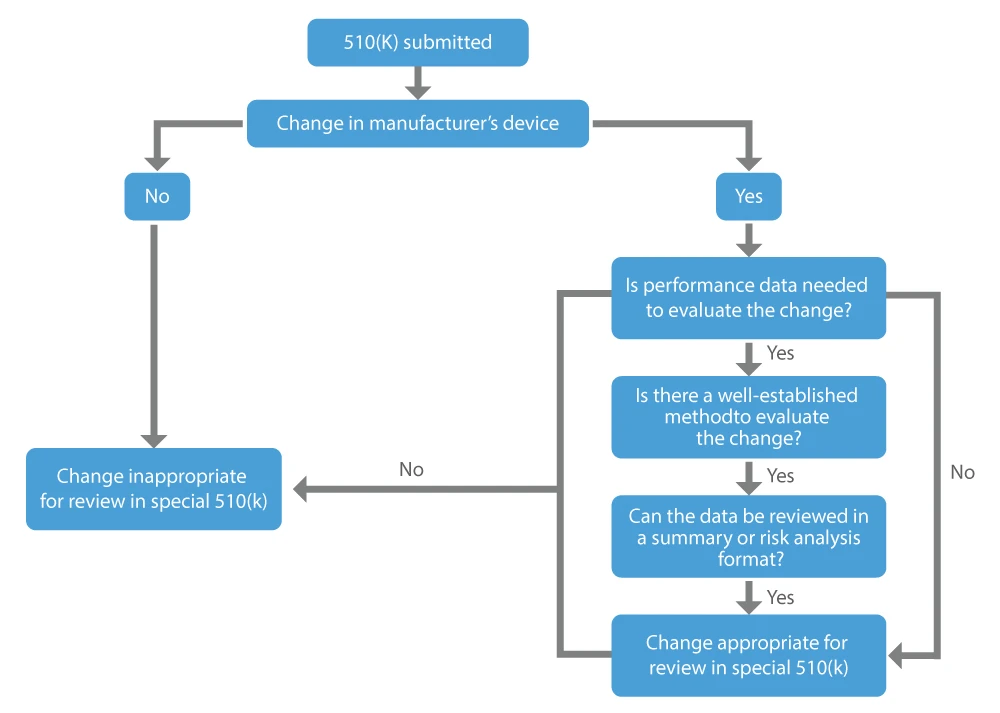
Lorsqu'un fabricant souhaite faire approuver les modifications qu'il a apportées à un dispositif déjà commercialisé, c'est-à-dire le dispositif existant, il peut demander un 510(k) spécial. Les principaux facteurs à prendre en compte pour déterminer si une modification apportée à un dispositif existant peut faire l'objet d'un 510(k) spécial sont les suivants :
- La modification concerne le dispositif prédicat commercialisé légalement par le demandeur.
- Les données de performance ne sont pas requises, ou des méthodes bien établies sont disponibles si elles sont jugées nécessaires pour évaluer le changement.
- Toutes les données de performance permettant de justifier une détermination d'équivalence en substance peuvent être examinées sous forme de résumé ou d'analyse de risque.
Documents requis pour le 510(k) spécial
- Lettre de motivation
- Le nom du dispositif légalement commercialisé (existant) du fabricant et le numéro 510(k)
- Une description détaillée de la ou des modifications apportées au dispositif qui ont entraîné la soumission d'un nouveau 510(k)
- Une comparaison entre le dispositif modifié et le dispositif autorisé sous forme de tableau
- Autres modifications de l'étiquetage ou de la conception
- Un résumé concis des activités de contrôle de la conception
- Sur la base de l'analyse des risques, une identification des activités de vérification et/ou de validation requises pour se conformer au 21 CFR 820.30
- Formulaire d'indication d'utilisation
- Une déclaration selon laquelle le déposant s'est conformé et n'est pas actuellement en infraction avec les exigences de la procédure de contrôle de la conception telles que spécifiées dans le 21 CFR 820.30 et que les dossiers sont disponibles pour examen sur demande.
Calendrier spécial d'examen 510(k) par laFDA US
Selon les lignes directrices de la FDAintitulées "Refuse to Accept Policy for 510(k)s", le délai d'examen des demandes spéciales 510(k) est de trente (30) jours à compter de leur réception.
Quand demander un 510(k) spécial ?
FDA US FDA des efforts constants pour fournir des dispositifs médicaux sûrs et efficaces afin de promouvoir la santé humaine. Le programme spécial 510(k) est efficace et conforme à la procédure d'examen la moins contraignante qui aide les fabricants étrangers à vendre leurs dispositifs aux États-Unis et permet aux patients d'avoir accès en temps opportun à de nouveaux dispositifs médicaux.
Pour toute clarification supplémentaire sur le processus spécial 510(k) de la FDA, reach Freyr - un expert réglementaire reconnu. Restez informé. Restez conforme.